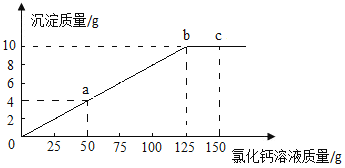
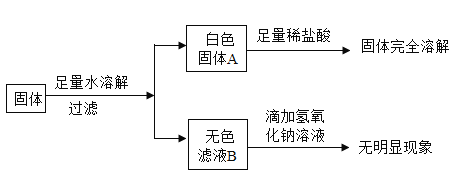
题目内容
【题目】化学是一门以实验为基础的科学,下面是初中化学中几个重要的对比实验。
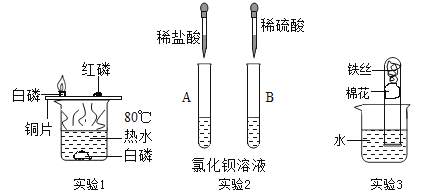
(1)实验1中,观察到铜片上的白磷燃烧而红磷不燃烧,可得出可燃物燃烧的一个条件为______。
(2)通过实验2所示酸的性质实验,可认识到:虽然酸类物质具有相似的化学性质,但由于不同的酸溶于水时电离出的______不同,其性质也存在差异。
(3)实验3中,一星期后,铁丝锈迹斑斑,铁生锈的条件是铁和______、______共同作用。
【答案】温度要达到着火点 阴离子或酸根离子 水 氧气
【解析】
(1)白磷的着火点是40℃,80℃的热水可以达到其着火点,而红磷的着火点高,热水不能使其达到着火点。因此根据铜片上的白磷燃烧而红磷不燃烧的事实,可得出可燃物燃烧的一个条件是:温度要达到着火点。
(2)酸类因为溶于水时电离出的阳离子相同,有相同的化学性质,又因为溶于水时电离出的阴离子或酸根离子不同,其性质也存在差异。比如稀盐酸不能和氯化钡反应,而稀硫酸能和氯化钡反应。
(3)实验3中铁丝发生锈蚀且试管中液面上升,由此得出铁丝锈蚀的过程,实际上是铁与水、氧气共同作用发生化学反应的过程。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
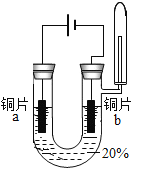
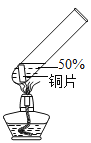
小学生10分钟应用题系列答案【题目】在探究金属与酸的反应时,发现铜片与 20%的硫酸溶液不反应。有同学提出疑问“在一定条件下铜与硫酸能否发生反应”,并进行了系列实验。
(查阅资料)SO2 能让红色的品红溶液褪色,能被 NaOH 溶液吸收。
(进行实验)(夹持仪器略)
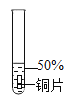
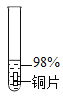
实验 1:初步实验(所用溶液均为硫酸溶液)
实验序号 | 1-1 | 1-2 | 1-3 | 1-4 | 1-5 |
装置 |
|
|
|
|
|
主要现象 | 铜片 a 附近溶液逐渐变 蓝,铜片 b 附近产生无 色气泡。 | 无明显现象 | 无明显现象 | 无明显现象 | 铜片溶解,溶液变蓝,生成有刺激性气味的无色气体 |
经检验实验 1-1 中产生的气体是氢气。
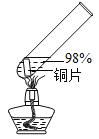
实验 2:在实验 1-5 的基础上深入探究,装置如图。
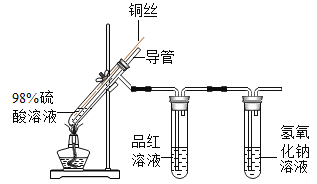
(解释与结论)
(1)实验 1-1 中, 能证明铜发生反应的现象是__________________。
(2)实验 1 中,欲得出“升高温度可使铜与硫酸反应” 需对比的实验是______________(填实验序号)。
(3)实验 1-5 和实验 2 中,推测放出的气体含 SO2,从元 素守恒的说明理由:_________________。
(4)实验 2 中,能证明有 SO2 生成的实验现象是______________。
(5)补全实验 1-5 和实验 2 中铜与硫酸反应的化学方程式:Cu +2H2SO4(浓)![]() CuSO4+SO2↑+______________。
CuSO4+SO2↑+______________。
(反思与评价)
(6)下列说法不正确的是______________。
A对比实验 1-2 和 1-5,可得出“增大浓度可使铜与硫酸反应”
B通电可促进一些化学反应的发生
C铜与硫酸只能发生一种化学反应