��Ŀ����
����Ŀ�����г�������Ʒ20g��Ϊ�˲ⶨ�����������ĺ�����ͬѧ����ʵ�鰸�ҵ�һƿδ֪Ũ�ȵ�ϡ�����������������16%������������Һ��ʵ�������ͼ��ʾ����ش����⣺

��1��д����������ϡ���ᷢ����Ӧ�Ļ�ѧ����ʽ_____��
��2���ó�����ʯ���������ĺ���Ϊ_____��
��3��������֪�����г��μӷ�Ӧ���Ȼ���������x���ı���ʽ_____��
��4����������������Һ�м���2.7gˮ�������ò�������Һ��������������Ϊ_____��
��5������������������Ϊ36.5%��Ũ��������ʵ������ϡ���ᣬ����ҪŨ�����ˮ��������Ϊ_____��
��6������20t����������ʯ�����������ʯ��������Ϊ84%������Ƶú�����4%����������Ϊ_____t��
���𰸡�Fe2O3+6HCl�T2FeCl3+3H2O 80% ![]() ��������Ҳ�� 11.7% 2��3 9.8
��������Ҳ�� 11.7% 2��3 9.8
��������
�⣺25g16%������������Һ����������100g16%������������Һ��ʼ����������һ��ʱ���ʼ�������ɫ����������Ϊ10.7g�������ɵ��������Ƶ�����Ϊ10.7����֪��ʼ�õ�����Һ����ʣ���HCl��������������������һ����Һ�����Ե�ȫ����ҺʱӦ�ö�Ӧ200g16%������������Һ��Ӧ����21.4g��������������
������ʯ������������������Ϊy�����ɵ��Ȼ���������Ϊx
Fe2O3+6HCl�T2FeCl3+3H2O
FeCl3+3NaOH��Fe��OH��3��+3NaCl
�ɵù�ϵʽΪ��
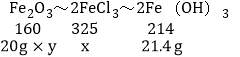
![]()
x��32.5g
y��80%
�������õ�����Һ��Ӧ����һ�����Һ���������ĵ������������һ�롣
�����ɵ��Ȼ��Ƶ�����Ϊa�����ĵ���������Һ��������Ϊb
HCl�е���Ԫ�����պ����������е���Ԫ�ؽ�ϣ��ɵù�ϵʽΪ
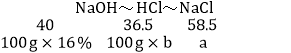
![]()
a��23.4g
b��14.6%
��������������Ϊ36.5%��Ũ��������ʵ������ϡ���ᣬ����ҪŨ����![]() ����Ҫ��ˮ������Ϊ200g��80g��120g��
����Ҫ��ˮ������Ϊ200g��80g��120g��
Ũ�����ˮ��������Ϊ80��120��2��3��
����������Һ�м���2.7gˮ�������ò�������Һ��������������Ϊ![]()
��20t����������ʯ�����������ʯ��������Ϊ84%������Ƶú�����4%����������Ϊz
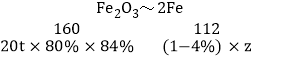
![]()
z��9.8t