题目内容
【题目】金属对人类的生产生活和社会发展有着极其重要的作用。
(1)下列用品中,主要利用金属导电性的是_____(填字母)
A 铂金饰品 B 铁锅 C 铝导线
(2)铁制品锈蚀的过程,实际上是铁跟空气中的氧气和_____发生化学反应的过程。
(3)工业上常用赤铁矿(主要成分是Fe2O3)与CO在高温下炼铁,反应的化学方程式是_____。
(4)在氯化铜和氯化亚铁的混合溶液中加入一定质量的镁粉,充分反应后过滤,得到滤渣和滤液。①滤液中一定含有的溶质是_____(填化学式);②向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是_____(填化学式)。
【答案】C 水 3CO+Fe2O3![]() 2Fe+3CO2 MgCl2 Fe、Cu
2Fe+3CO2 MgCl2 Fe、Cu
【解析】
(1)A、铂金饰品,利用的金属的光泽和稀有,故A错误;
B、铁锅利用的铁的导热性,故B错误;
C、铝导线利用的铝的导电性,故C正确;
故选C。
(2)铁的锈蚀实际是铁与空气中的水和氧气共同作用的结果;故填:水。
(3)工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO![]() 2Fe+3CO2。故填:3CO+Fe2O3
2Fe+3CO2。故填:3CO+Fe2O3![]() 2Fe+3CO2。
2Fe+3CO2。
(4)镁的金属活动性比铁、铜强,在氯化铜和氯化亚铁的混合溶液中加入一定质量的镁粉,镁先与氯化铜溶液反应生成氯化镁溶液和铜,氯化铜反应完,若还有镁粉,镁才能与氯化亚铁溶液反应生成氯化镁溶液和铁。
①由于不知加入镁粉的质量,可能是镁与氯化铜溶液、氯化亚铁溶液恰好完全反应,均生成氯化镁溶液,故滤液中一定含有的溶质是氯化镁,其化学式为:MgCl2。
②滤渣中一定含有银,可能含有铁和镁(过量剩余的),铜不与稀盐酸反应,铁能与稀盐酸反应生成氢气,向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是铜和铁(化学式分别是Cu、Fe),可能含有镁。故填:MgCl2;Fe、Cu。

【题目】红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示。同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究。

(提出问题)久置固体的成分是什么?
(查阅资料)铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
(猜想)久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3。
(实验探究1)甲同学的方案:
实验操作 | 实验现象 | 实验结论 |
(1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红 | 固体中一定含有____和Ca(OH)2. |
(2)另取少量固体放于试管中,滴加足量的____ | 固体逐渐消失,有无色气体产生,得到浅绿色溶液 | 固体中一定含有Fe,一定不含Fe2O3 |
(3)将步骤(2)中产生的气体通入到澄清石灰水中 | ____ | 固体中一定含有CaCO3 |
(实验质疑)
(1)乙同学认为甲同学的实验中不能得出一定含Ca(OH)2的结论,理由是_____。
(2)丙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是_____。
(实验探究2)
乙、丙同学设计如下实验方案继续验证:
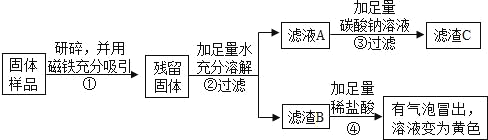
(1)③中反应的化学方程式是_____。
(2)乙、丙同学实验中能得出固体样品中一定还含有_____,仍有一种物质不能确定,该物质是_____。
(3)乙、丙同学又经过实验测得上述残留固体中含钙物质的总质量为1.6g,滤渣B中CaCO3的质量为1.0g,滤渣C的质量为1.0g。
(实验结论)综合上述实验及所给数据,久置固体的成分是_____。