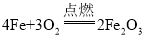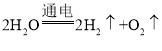题目内容
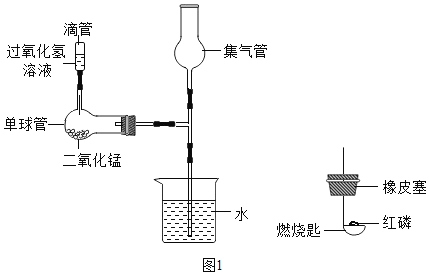
【题目】已知某固体样品A可能是NH4NO3和MgCO3或两者之一,另有一固体样品B,其中可能含有Na2SO4、BaCl2、CuSO4、KCl四种物质中的一种或多种,按下图所示进行探究实验,出现的现象如图中所述(设计过程中所有发生的反应都恰好完全反应)。
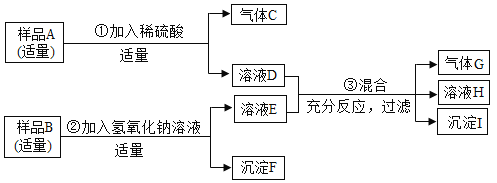
试根据实验过程和发生的现象,填写以下空白。
(1)将气体C通入紫色石蕊试液,试液变_____色。
(2)沉淀F的化学式为_____。
(3)溶液D中,一定存在的阳离子是_____(填写离子符号)。
(4)写出步骤③中生成沉淀I的化学方程式_____。
(5)在溶液H中,肯定存在的阴离子有_____种。
(6)固体样品B中,一定不存在的物质是_____(填写化学式),得出此结论的理由是_____。
【答案】红 BaSO4 Mg2+和NH4+ MgSO4+2NaOH=Mg(OH)2↓+Na2SO4 3 CuSO4 若固体样品B中存在CuSO4,则溶液E中不含有NaOH,则步骤③后不会生成气体G
【解析】
样品A加入稀硫酸,有气体生成,说明A中一定含有碳酸镁,可能含有硝酸铵;样品B中加入氢氧化钠溶液后,生成沉淀F和溶液E.溶液E与溶液D混合后,有气体G生成.根据A、B中可能含有的物质可知,生成的气体G为氨气,则A中一定含有硝酸铵.则E中含有氢氧化钠,即样品B中没有与氢氧化钠反应的物质,所以样品B中一定不含硫酸铜,则生成的沉淀F为硫酸钡沉淀,即样品B中一定含有的物质是硫酸钠与氯化钡,可能含有氯化钾。氢氧化钠与溶液D中的硫酸镁反应生成的沉淀I为氢氧化镁。
(1)C为二氧化碳,二氧化碳与水反应生成碳酸,碳酸可使紫色石蕊试液变红。
(2)由以上分析可得F为BaSO4。
(3)溶液D为硝酸铵和生成的硫酸镁溶液,所以一定存在的阳离子是Mg2+、NH4+。
(4)步骤③中生成氢氧化镁沉淀的化学方程式为MgSO4+2NaOH=Mg(OH)2↓+Na2SO4。
(5)溶液H中肯定存在的阴离子为Cl﹣、SO42﹣、NO3﹣,共3种。
(6)由以上分析可得,固体样品B中,一定不存在的物质是CuSO4,原因是若固体样品B中存在CuSO4,则溶液E中不含有NaOH,则步骤③后不会生成气体G。

 高中必刷题系列答案
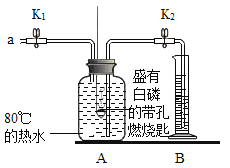
高中必刷题系列答案【题目】某同学要探究燃烧的条件利空气中氧气的含量,进行了如下实验。
(已知:白磷的着火点为40 °C)
实验装置 | 实验步骤及现象 |
| 步骤Ⅰ.检查装置的气密性,气密性良好。 步骤Ⅱ.将盛有足量白磷的带孔燃烧匙伸入A瓶中,白磷不燃烧。 步骤Ⅲ.向A瓶中加满80 C热水,塞紧瓶塞,白磷不燃烧。 步骤Ⅳ.打开K1、K2,从a口向A瓶中鼓入空气,待瓶中的液面低于燃烧匙底部时,关闭K1、K2。此时进入量筒B中水的体积为200 mL,观察到A瓶中的白磷燃烧。 |
(1)通过步骤___可知可燃物燃烧的条件之一是要有氧气。
(2)待装置冷却一段时间后,打开K2,如果观察到____,说明空气中氧气的体积约占1/5,若该实验测得空气中氧气的体积分数小于1/5,原因可能是___。