题目内容
【题目】有铁粉和铜粉的均匀混合物,甲、乙、丙三位同学分别取该混合物与稀硫酸反应,所得数据如下表所示:
甲 | 乙 | 丙 | |
取用金属混合物的质量/g | 10 | 10 | 20 |
取用稀硫酸的质量/g | 100 | 120 | 100 |
反应后过滤,得干燥固体的质量/g | 4 | 4 | 13 |
请分析数据,回答下列问题:
(1)金属混合物中Cu的质量分数
(2)计算丙同学所得溶液中溶质的质量分数(计算结果精确到0.1%)
【答案】(1)40% (2)17.8%
【解析】
(1)根据金属的活动性关系铁>氢>铜,铁能与稀硫酸反应生成硫酸亚铁同时放出氢气,而铜不能与稀硫酸反应,当把金属混合物放入足量稀硫酸中充分反应时,剩余固体为铜。比较甲、乙两组数据可以知道,取10g混合物,分别与100g硫酸和120g硫酸反应都剩余4g固体,说明混合物中的铁全部参加反应,可以判断10g混合物中含有铜的质量为4g,含铁的质量为6g,所以混合物中铜的质量分数为![]() 。
。
(2)参加反应的铁的质量为:20g﹣13g=7g
设生成硫酸亚铁的质量为x,生成氢气的质量为y
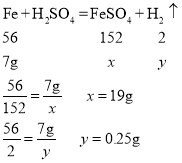
所以反应后溶液质量为:20g﹣13g+100g﹣0.25g=106.75g
反应后溶液中硫酸亚铁的质量分数为![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】小明同学拆开某食品的包装袋,发现袋里有一个装固体的小纸袋,上面写着“干燥剂,主要成分生石灰,请勿食”;小明决定对干燥剂进行探究。
(提出问题)这包干燥剂是否变质,成分是什么?
(猜想与假设)猜想一:全部是CaO;猜想二:CaO和Ca(OH)2;猜想三:全部是Ca(OH)2;猜想四:Ca(OH)2和CaCO3;猜想五:_____。
(实验探究)
实验操作及步骤 | 实验现象 | 实验结论 |
①取部分干燥剂于试管中,加水 | 无放热现象 | 猜想_____不正确 |
②向①中的溶液滴加稀HCl溶液 | 有气泡产生 | 猜想_____不正确 |
③另取部分干燥剂,加水并搅拌,静置后过滤,取上清液,通入足量的CO2 | _____ | 猜想四正确 |
写出实验③中发生反应的化学方程式:_____。
(拓展运用)小明同学反思了干燥剂变质的原因,认识到实验室保存氧化钙应注意_____。
【题目】某实验小组的同学为了测定CaCl2和NaCl的混合物中CaCl2的含量,他们取样品25.8g于烧杯中,加入134.2g水全部溶解,再多次加入某Na2CO3溶液充分反应。加入Na2CO3溶液 与产生沉淀的质量如下表所示:
Na2CO3溶液/g | 10 | 10 | 10 | 10 | 10 | 10 |
沉淀质量/g | 5 | 10 | 15 | 20 | 20 | m |
(1)Na2CO3中钠、碳、氧三种元素的质量比为_____,表中m=_____。
(2)样品中CaCl2的质量是____;恰好完全反应时,所得溶液中溶质的质量分数是____。