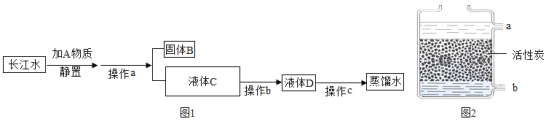
题目内容
【题目】某同学为了测定生铁样品中铁的质量分数,将60g 稀盐酸分3次加入到盛有4g 该样品的烧杯中(样品中只有铁与稀盐酸反应),所得数据如表,则下列说法中正确的是( )
实验次数 物质质量 | 第1次 | 第2次 | 第3次 |
加入稀盐酸的质量/g | 20 | 20 | 20 |
充分反应后剩余固体的质量 | 2.6 | 1.2 | 0.1 |
A.第1次和第2次产生氢气的质量不同
B.第2次和第3次剩余固体中均有铁
C.第3次充分反应后溶液中溶质只有FeCl2
D.生铁样品中铁的质量分数为97.5%
【答案】D
【解析】
第一次加入20 g盐酸减少的固体即反应的铁的质量为4 g﹣2.6 g=1.4 g,第二次加入20 g盐酸减少的固体即反应的铁的质量为2.6 g﹣1.2 g=1.4 g,而第三次减少的固体为1.2 g﹣0.1 g=1.1 g,所以此时铁反应完全,而稀盐酸有剩余,剩余的固体为碳,质量为0.1 g。A、第一次和第二次等质量的铁和等质量的盐酸反应得到氢气质量也相等,错误;B、第二实验后铁有剩余,而第三次实验后剩余的只有碳,没有铁,错误;C、第三次实验后由于盐酸有剩余,所以溶质为HCl和FeCl2,错误;D、生铁中铁的质量分数为![]() ×100%=97.5%,正确。故选D。
×100%=97.5%,正确。故选D。

【题目】某化学兴趣小组对实验室制备氧气的条件进行如下探究实验。
(1)为探究催化剂的种类对氯酸钾分解速率的影响,甲设计以下对比实验:
Ⅰ.将3.0gKClO3与MnO2均匀混合加热
Ⅱ.将 xgKClO3与CuO均匀混合加热
在相同温度下,比较两组实验产生O2的快慢。
I中反应表达式是_____;Ⅱ中x的值应为______。
(2)乙探究了影响过氧化氢分解速率的某种因素。实验数据记录如下:
过氧化氢溶液的质量 | 过氧化氢溶液的浓度 | MnO2的质量 | 相同时间内产生O2体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
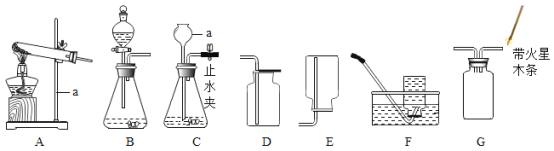
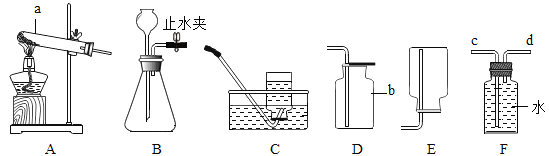
测量O2体积的装置是图甲中的________(填序号)。
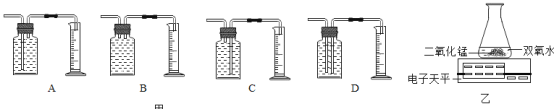
实验结论:在相同条件下,______,过氧化氢分解得越快。丙用图乙装置进行实验,通过比较_______也能达到实验目的。丁将盛有适量10%的过氧化氢溶液的试管加热,产生气泡明显增多。
实验结论:在相同条件下,_______,过氧化氢分解得越快。