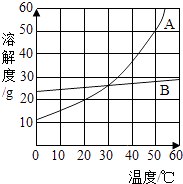
题目内容
【题目】氧化铜(CuO)是一种黑色固体,可溶于稀硫酸中.某同学想知道是稀硫酸中的H+、H2O和SO42﹣中的哪种粒子能使氧化铜溶解.请你和他一起通过如图所示三个实验来完成这次探究活动. 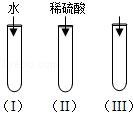
(1)你们可能提出的假设是: ①可能是H2O能使氧化铜溶解;
②;
③;
(2)通过实验(I)可以证明假设不成立;
(3)要证明另外两种粒子是哪一种能溶解氧化铜,还需要进行实验(Ⅱ)和(Ⅲ):可以在(Ⅲ)中加入溶液,通过的现象来证明不是(填离子符号)溶解的氧化铜;
(4)探究的结论为;
(5)氢气还原氧化铜实验后,试管内壁上往往留有一层薄薄的“铜镜”,设计了如下实验步骤来除去“铜镜”.请写出实验原理(用化学方程式表示)将试管放在酒精灯上加热至铜镜变黑;加入稀硫酸充分反应: .
【答案】
(1)可能是H+使CuO溶解;可能是SO42﹣使CuO溶解
(2)①
(3)Na2SO4等;固体不溶解;SO42﹣
(4)稀硫酸中的H+使CuO溶解
(5)2Cu+O2 ![]() 2CuO;CuO+H2SO4=CuSO4+H2O
2CuO;CuO+H2SO4=CuSO4+H2O
【解析】解:(1)稀硫酸中存在水分子、氢离子、硫酸根离子,可能是稀硫酸中的水分子、氢离子或硫酸根离子中的一种使氧化铜溶解;所以答案是:可能是H+使CuO溶解;可能是SO42﹣使CuO溶解;(2)实验I中,氧化铜不溶解,说明水分子不能使氧化铜溶解;故填:①;(3)因为Ⅰ实验证明了H2O不能使CuO溶解的结论,实验Ⅱ中既有H+ , 又有SO42﹣和H2O,其中水分子已经证明了不能使CuO溶解,而且知道实验Ⅱ中的现象是氧化铜溶解,但三个实验必须得出实验结果,如果实验三再加盐酸,那硫酸根就没法证明了,所以实验Ⅲ中应加入的物质应该是含硫酸根的溶液;故填:Na2SO4等;固体不溶解;SO42﹣;(4)通过实验可以得知,水分子和硫酸根离子都不能使氧化铜溶解,使氧化铜溶解的是氢离子,只有含有大量氢离子的溶液才可以和氧化铜反应,使之溶解;故填:稀硫酸中的H+使CuO溶解;(5)因为铜不活泼,所以根据所学知识可以先将铜灼烧变为氧化铜,再用酸溶解,洗涤即可;故反应的方程式分别为:2Cu+O2 ![]() 2CuO;CuO+H2SO4=CuSO4+H2O.
2CuO;CuO+H2SO4=CuSO4+H2O.
【考点精析】本题主要考查了书写化学方程式、文字表达式、电离方程式的相关知识点,需要掌握注意:a、配平 b、条件 c、箭号才能正确解答此题.

【题目】实验设计是化学实验的重要环节,请根据下列实验要求回答相关问题: 【活动与探究一】用对比实验方法探究二氧化碳的性质.
实验一 | 实验二 |
|
|
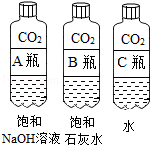
(1)实验一中振荡3个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生反应的化学方程式为;对比A瓶与(填“B”或“C”) 瓶的实验现象,可证明CO2能与NaOH发生反应.
(2)实验二观察到C装置中发生的现象是 , 结论是(用语言表示).
(3)【活动与探究二】用变量控制方法探究影响物质溶解性的因素.
实验三 | 实验四 |
|
|
实验三目的是探究对硝酸钾溶解性的影响;实验四是探究对物质溶解性的影响.