题目内容
【题目】化学与我们的生活密切相关.
(1)制作饺子的原料有:面粉、肉馅、蔬菜、植物油、调味剂等,其中富含糖类的是 .
(2)小明去采摘草莓. ①草莓大棚所用的塑料薄膜属于(填序号,下同);
A.有机合成材料 B.无机材料 C.复合材料
②用发酵后的牛奶做肥料,种出的草莓又大又甜.发酵后的牛奶含有C、H、O和N等元素.浇“牛奶”相当于施加了 .
A.氮肥 B. 磷肥 C.钾肥 D.复合肥
(3)①金属材料在国防建设中起着重要的作用. 
工业生产中常用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为;
②小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图2所示的两个实验:
Ⅰ.实验1中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不合理,理由是;
Ⅱ.通过实验2,可证明铁的活动性比铜强,反应的化学方程式是 .
【答案】
(1)面粉
(2)A;A
(3)Fe2O3+6HCl=2FeCl3+3H2O;使用的酸的种类不同;Fe+CuSO4=Cu+FeSO4
【解析】解:(1)由常见的食品中含有的营养素可知,面粉中富含淀粉,淀粉属于糖类;(2)①塑料薄膜属于有机合成材料;②发酵后的牛奶含有N元素,浇“牛奶”相当于施加了氮肥;(3)①铁锈的主要成分是氧化铁,它能与稀盐酸反应生成氯化铁和水,反应方程式为:Fe2O3+6HCl=2FeCl3+3H2O;②Ⅰ.从图可以看出选取的酸的种类不同,因此以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱不够合理;Ⅱ.实验2中,若铁丝表面出现红色物质,溶液由蓝色变成浅绿色,可证明铁的活动性强于铜,该反应的化学方程式为:Fe+CuSO4═FeSO4+Cu. 故答案为:(1)面粉;(2)①A; ②A;(3)①Fe2O3+6HCl=2FeCl3+3H2O;②Ⅰ.使用的酸的种类不同;Ⅱ.Fe+CuSO4=FeSO4+Cu.
(1)根据常见的食品中含有的营养素分析回答;(2)①根据材料的分类进行分析;②根据化肥的分类进行分析;(3)①根据铁锈的主要成分是氧化铁,它能与稀盐酸反应生成氯化铁和水进行分析;②Ⅰ.从控制变量的角度进行分析;Ⅱ.若铁的活动性强于铜,则铁可置换出硫酸铜中的铜.

【题目】杂卤石(K2SO4MgSO42CaSO42H2O)属于“呆矿”,为能充分利用钾资源,用饱和的Ca(OH)2溶液浸杂卤石制备硫酸钾,工艺流程如下: 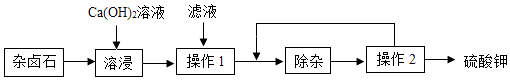
已知:
物质 | CaSO4 | K2SO4 | Mg(OH)2 |
溶解度/g(25℃) | 0.28 | 11.1 | 0.00084 |
(1)操作1的名称为 , 所需的玻璃仪器有玻璃棒、烧杯、 , 玻璃棒的作用是 .
(2)滤渣的主要成分有和 .
(3)“除杂”环节中,先加入溶液(填字母,下同),经搅拌等操作后,过滤,再加入 溶液调滤液pH至中性.
a.K2CO3 b.Na2CO3 c.稀硫酸 d.稀盐酸
(4)操作2的步骤是蒸发浓缩、、过滤、洗涤.
(5)洗涤硫酸钾最好选用 . a.30℃的水 b.饱和的硫酸钠溶液 c.饱和的硫酸钾溶液.