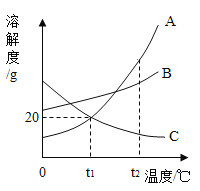
题目内容
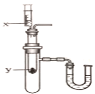
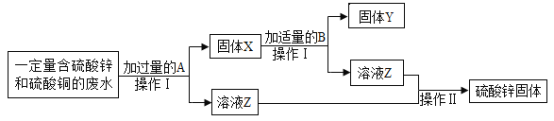
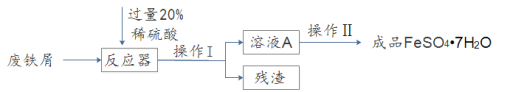
【题目】废铁屑的主要成份是铁,同时还有少量铁锈(主要成分是Fe2O3)等杂质,动物饲料硫酸亚铁的生产工艺之一如下图所示:
(1)实验室欲用98%的浓硫酸(密度为1.84g/ml)配制200g20%的稀硫酸,有以下实验步骤:a.量取;b.计算;c.稀释;d.装瓶贴标签。正确的顺序是__(填字母),若用量筒量取浓硫酸时俯视读数,其它操作正确,则所得溶液的质量分数___20%(填“>”、“<”或“=”)。
(2)在反应器中发生的化学反应①Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O;② Fe2(SO4)3 + Fe = 3FeSO4 ;③______。反应器所在的厂房要严禁烟火、加强通风的原因是________。
(3)溶液A中的溶质是______(填化学式)。
(4)操作Ⅰ的名称是_____,完成操作Ⅰ的玻璃仪器有:玻璃棒、烧杯和________,玻璃棒的作用_______。
(5)经过操作Ⅱ:____、降温结晶、过滤、冰水洗涤、低温干燥可得硫酸亚铁晶体(FeSO47H2O),用低温干燥说明硫酸亚铁晶体可能具有的性质是____。
(6)将无水硫酸亚铁(FeSO4)隔绝空气加强热,生成Fe2O3 和SO2、SO3两种气体,试写出该反应的化学方程式________。
【答案】bacd < Fe + H2SO4 =FeSO4 + H2↑ 防爆炸 FeSO4和H2SO4(填名称、少答不给分) 过滤 漏斗 引流 蒸发浓缩 受热易分解(受热不稳定、受热易发生化学变化等,合理即可) 2FeSO4![]() Fe2O3 + SO2↑ + SO3↑
Fe2O3 + SO2↑ + SO3↑
【解析】
(1)实验室欲用98%的浓硫酸(密度为1.84g/ml)配制200g20%的稀硫酸,实验步骤顺序应该是:计算、量取、稀释、装瓶贴标签,所以正确的顺序是:bacd;若用量筒量取浓硫酸时俯视读数,量取的浓硫酸偏少,造成溶质偏少,其它操作正确,则所得溶液的质量分数<20%。
(2)在反应器中发生了三个化学反应①Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O;② Fe2(SO4)3 + Fe = 3FeSO4 ;③Fe + H2SO4 =FeSO4 + H2↑。因为反应中生成氢气,氢气具有可燃性,在爆炸极限内遇明火,就可能发生爆炸,所以反应器所在的厂房要严禁烟火、加强通风,原因是:防爆炸。
(3)经过反应器中发生的三个反应,Fe2O3和Fe最终都转化为FeSO4,但由于稀硫酸过量,所以溶液A中的溶质是:FeSO4和H2SO4。
(4)操作Ⅰ实现了固体和液体的分离,该操作的名称是:过滤,完成操作Ⅰ的玻璃仪器有:玻璃棒、烧杯和漏斗,玻璃棒的作用:引流。
(5)因为反应过程中用的是20%的稀硫酸,反应后得到的溶液浓度较小,为了提高降温结晶的效率,所以操作Ⅱ的第一步应该蒸发浓缩。然后通过降温结晶、过滤、冰水洗涤、低温干燥可得硫酸亚铁晶体(FeSO47H2O),结晶水合物一般受热易失水,所以用低温干燥说明硫酸亚铁晶体可能具有的性质是:受热易分解(受热不稳定、受热易发生化学变化等,合理即可)。
(6)将无水硫酸亚铁(FeSO4)隔绝空气加强热,生成Fe2O3 和SO2、SO3两种气体,该反应的化学方程式是:![]() 。
。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案【题目】下图1为实验室用一氧化碳还原氧化铜的实验装置图,某兴趣小组在老师的指导下按下图连接装置、检查装置的气密性、装药品、固定装置。但就下面的实验操作顺序问题出现了分歧:小丽认为先通一段时间CO排净空气,然后再点燃A处酒精灯和C处酒精灯,小亮觉得这样做不好,他的理由是:_____;小亮主张先点燃A处酒精灯和C处酒精灯,然后再通CO,小菊又提出反对,她的理由是:_____,老师认他们的反对意见都有道理。请你帮助这两位同学解决他们的困难,你的办法是:_____。
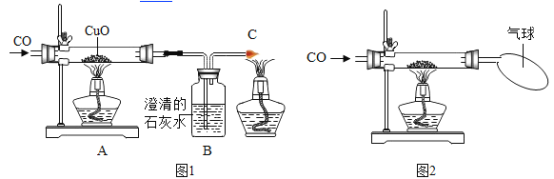
小红为了探究CO是否能还原CuO,做了如图2所示的实验。实验发现CO与CuO加热后黑色粉末变成红色粉末。请你参与该研究过程:
[研究课题]探究红色粉末的主要成分
[查阅资料]
(1)有关物质的颜色:Cu:红色,CuO:黑色,Cu2O:红色,CuSO4溶液:蓝色。
(2)CuO和Cu2O都能和稀硫酸发生反应,化学方程式为:
CuO十H2SO4=CuSO4+H2O; Cu2O+H2SO4=CuSO4+Cu+H2O
[猜想与实验]
(1)如果硬质玻璃管内红色粉末为一种物质,请猜想它的成分,并设计简单的实验证明你的猜测。
猜想 | 简单实验方案 | 现象 | CO和CuO反应的化学方程式 |
_____ | _____ | _____ | _____ |
_____ | _____ | _____ | _____ |