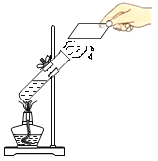
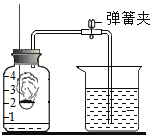
题目内容
【题目】以下是某研究小组探究影响反应速率部分因素的相关实验数据。
实验序号 |
|
| 温度 | 二氧化锰的用量 | 收集氧气的体积 | 反应所需的时间 |
| 5 | 1 | 20 |
| 4 |
|
| 15 | 1 | 20 |
| 4 |
|
| 30 | 5 | 35 | ______ | 2 |
|
| 30 | 5 | 55 | ______ | 2 |
|
(1)写出实验![]() 中反应的文字表达式______。
中反应的文字表达式______。
(2)通过实验![]() 和
和![]() 对比可知,化学反应速率与______有关;从实验
对比可知,化学反应速率与______有关;从实验![]() 和
和![]() 对比可知,化学反应速率与温度的关系是
对比可知,化学反应速率与温度的关系是![]() ______。
______。
(3)化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的碰撞概率有关。试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是______。
(4)用一定量![]() 的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总重量______
的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总重量______![]() 选填“减小”或“不变”或“增大”
选填“减小”或“不变”或“增大”![]() 。
。
【答案】![]() 过氧化氢溶液的浓度 其它条件相同时,温度越高过氧化氢分解速率越快 反应物的浓度越大,单位体积的反应物中含有的微粒数越多,微粒间碰撞的概率越大,化学反应速率越快 不变
过氧化氢溶液的浓度 其它条件相同时,温度越高过氧化氢分解速率越快 反应物的浓度越大,单位体积的反应物中含有的微粒数越多,微粒间碰撞的概率越大,化学反应速率越快 不变
【解析】
过氧化氢在二氧化锰的催化作用下生成水和氧气。
(1)过氧化氢在二氧化锰的催化作用下生成水和氧气;故反应的文字表达式为过氧化氢![]() 水
水![]() 氧气。
氧气。
(2)通过实验![]() 和
和![]() 对比可知,化学反应速率与过氧化氢溶液的浓度有关;从实验
对比可知,化学反应速率与过氧化氢溶液的浓度有关;从实验![]() 和
和![]() 对比可知,化学反应速率与温度的关系是:其它条件相同时,温度越高过氧化氢分解速率越快;此两组中所取二氧化锰的质量仍为
对比可知,化学反应速率与温度的关系是:其它条件相同时,温度越高过氧化氢分解速率越快;此两组中所取二氧化锰的质量仍为![]() 。
。
(3)“反应物浓度越大,化学反应速率越快”的原因是反应物的浓度越大,单位体积的反应物中含有的微粒数越多,微粒间碰撞的概率越大,化学反应速率越快;故原因是反应物的浓度越大,单位体积的反应物中含有的微粒数越多,微粒间碰撞的概率越大,化学反应速率越快。
(4)用一定量![]() 的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,但是产生氧气的总重量不变。
的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,但是产生氧气的总重量不变。

【题目】用久置的镁条做实验时,需要用砂纸把表面的灰黑色打磨掉,直到露出光亮的银白色.实验小组同学对镁条表面“灰黑色外衣”的成分进行如下探究.
【提出问题】镁条表面“灰黑色外衣”的成分是什么?
【猜想与假设】
Ⅰ.是镁与空气中的氧气反应生成的氧化镁.
Ⅱ.是镁与空气中的二氧化碳反应生成的黑色碳单质.
Ⅲ.根据铜锈的成分是碱式碳酸铜,推测镁条表面的“灰黑色外衣”是镁在潮湿的空气中生锈得到的碱式碳酸镁.
同学们经讨论,从颜色上否定了只含有氧化镁,因为氧化镁是 .
【查阅资料】
①碱式碳酸镁的性质有:受热可分解;常温下能与稀硫酸反应.
②白色的硫酸铜粉末遇水能变为蓝色.
③碳不与稀硫酸反应,但与浓硫酸在加热条件下能反应并生成CO2、SO2和H2O.
同学们认为碳与浓硫酸反应生成三种产物的共同点是 (答出一点即可).
【进行实验】
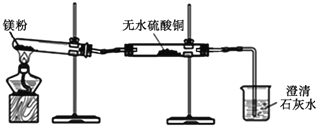
(1)同学们用久置的镁粉进行了如下实验.
实 验 装 置 |
|
实 验 现 象 | ①无水硫酸铜粉末逐渐由白色变为蓝色 ②澄清石灰水变浑浊 |
结 论 | 久置的镁粉中除镁元素外,还含有的元素是 久置的镁粉中含有碱式碳酸镁 |
(2)同学们发现,经加热一段时间后,试管中镁粉会突然“噗”地燃烧起来,出现红热,很快停止,并有黑色固体粘附在试管壁上.
①将试管取下,冷却后加入足量稀硫酸,大部分固体溶解,并有气泡出现,但黑色固体没有消失.请写出有气体生成的一个反应化学方程式 .
②将实验①试管中的混合物进行 (填操作名称),除去其中溶液,向黑色固体中加入浓硫酸,加热.黑色固体全部溶解,得澄清溶液并伴有刺激性气味的气体产生.
实验(2)说明,镁在CO2中可以燃烧,生成了碳单质.
【实验结论】
综合上述实验现象,实验小组认为镁条表面“灰黑色外衣”中含有碳和碱式碳酸镁.
【反思与评价】
有的同学提出,实验(2)不足以证明镁条表面“灰黑色外衣”中含有碳,他的理由是 .