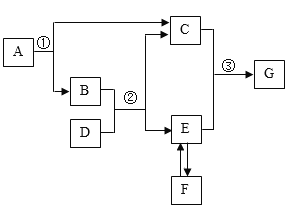
��Ŀ����
����Ŀ����ҵ���������̿���Ҫ�ɷ�MnO2���Ʊ�������ص�������ͼ��ʾ���ش��������⣺����Ϣ��ʾ��MnO2������ˮ�����ػ������������ˮ��
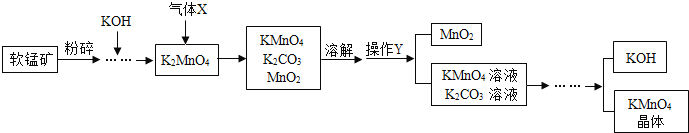
��1�������̿�����Ŀ����_____��
��2��������ͨ�������X��_____�����ţ�
A N2 B CO2 C H2
��3������Y��������_____��
��4�����������п�ѭ�����õ�������_____��
��5��������ؿ�����ʵ������ȡ��������Ӧ�Ļ�ѧ����ʽΪ_____��
���ݻ�ѧ����ʽ���㣬����ռ���100.0g��������������Ҫ������ص�����Ϊ____����������ȷ��0.1g��
��6����֪���̿��к�26.1t������MnO2�����Ƶ�31.6tKMnO4��������������ѭ�����Ʊ������е���ʧ����μӷ�Ӧ��MnO2�����ɵ�KMnO4����ԭ�ӵĸ�����Ϊ_____������������ȣ���
���𰸡������˷�Ӧ��ĽӴ�������ӿ췴Ӧ���ʣ���ַ�Ӧ B ���� KOH��MnO2 2KMnO4![]() K2MnO4+MnO2+O2�� 987.5g 3:2
K2MnO4+MnO2+O2�� 987.5g 3:2
��������
��1�������̿�����Ŀ���������˷�Ӧ��ĽӴ�������ӿ췴Ӧ���ʣ���ַ�Ӧ����������˷�Ӧ��ĽӴ�������ӿ췴Ӧ���ʣ���ַ�Ӧ��
��2���������غ㶨���Լ�������K2CO3��֪��ͨ�������к���̼Ԫ�أ����B��
��3������Y�ǽ������Թ�����Һ����Է��룬�ǹ��˲�����������ˣ�
��4��ѭ��ʹ�õ����ʼ��Ƿ�Ӧ�����������ж����е����ʣ���Ӧ�����������о���������������������̣���ѭ��ʹ�õ����ʣ����KOH��MnO2��
��5���ڼ��ȵ������£�������طֽ�Ϊ����ء��������̺����������2KMnO4![]() K2MnO4+MnO2+O2����
K2MnO4+MnO2+O2����
����Ҫ������ص�����Ϊx��
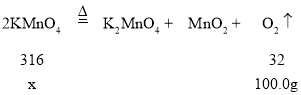
![]()
x��987.5g
�ʴ�Ϊ��987.5g��
��6����������ɵ�����ת����ϵ����������̺�����ص��������ֱ�Ϊx��y��
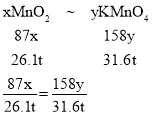
![]()
�ʴ�Ϊ��3��2��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�