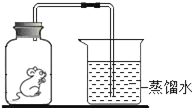
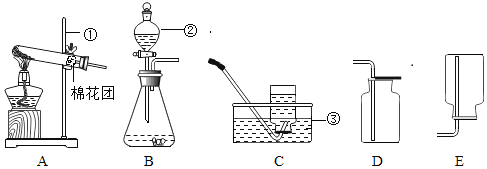
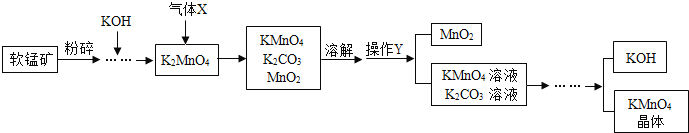
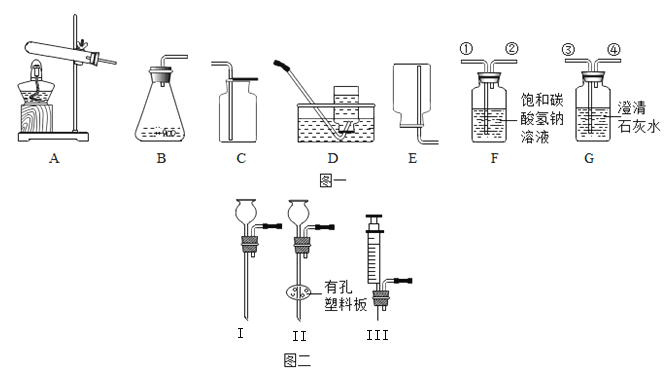
题目内容
【题目】下列关于化学方程式:CH4+2O2![]() 2H2O+CO2的认识,错误的是( )
2H2O+CO2的认识,错误的是( )
A. 定性上,甲烷具有可燃性
B. 微观上,参加反应的甲烷分子和氧分子的个数比为1:2
C. 宏观上,点燃条件下甲烷与氧气完全反应生成水和二氧化碳
D. 定量上,每8g甲烷和32g氧气完全反应生成9g水和22g二氧化碳
【答案】D
【解析】
A、由化学方程式可知,甲烷能够燃烧生成水和二氧化碳气体,故甲烷具有可燃性,正确;
B、从微观上,1个CH4分子和2个O2分子在点燃条件下,生成1个CO2分子和2个H2O分子,故参加反应的甲烷分子和氧分子的个数比为1:2,故选项正确;
C、在反应中“+”读作“和”,该反应可读作:甲烷和氧气在点燃条件下,反应生成二氧化碳和水,故选项读法正确。
D、该反应可读作:每16份质量的甲烷和64份质量的氧气在点燃条件下恰好反应生成44份质量的二氧化碳和36份质量的水,则每8gCH4和32gO2在点燃条件下能充分反应,生成18g水和22g二氧化碳,故选项读法错误。
故选:D。

【题目】过氧化钠是化学中常见的一种药品,它是浅黄白色颗粒粉末。在空气中吸收水分和二氧化碳。易溶于水,与水中能发生反应生成氢氧化钠和过氧化氢,方程式:Na2O2+2H2O=2NaOH+H2O2,过氧化氢又能分解放出氧气。
(1)区分水和过氧化氢的实验方法是:_____;发生的反应方程式是:_____。
(2)某同学为了证明过氧化钠加入水中生成了氢氧化钠,在生成的溶液中滴加了几滴无色酚酞试液,观察到的现象是溶液先变红后褪为无色,请你对此现象进行探究。
(提出问题):什么导致溶液先变红再褪色?
(猜想与假设):猜想1:甲同学“可能是无色酚酞溶液变质导致溶液褪色”;
猜想2:乙同学“可能是生成的过氧化氢使溶液褪色”。
(实验与结论):a:甲同学提出的猜想,立即遭到其他同学的反对,因为_____;
b:为了验证自己的猜想,乙同学设计了以下方案并实验验证:
实验步骤 | 实验现象 | 实验结论 |
取少量稀氢氧化钠溶液于试管中,滴加1—2滴酚酞试液,变红后_____观察现象 | 溶液依然为_____色 | _____ |
(讨论交流):你还能提出不同的猜想吗?
猜想3:_____。
方案3:
实验步骤 | 实验现象 | 实验结论 |
_____ | _____ | _____ |