题目内容
【题目】向500g![]() 溶液中加入11.2克Fe和Cu的混合粉末,充分反应后过滤、洗涤、干燥得34.8g滤渣和一定质量的滤液,经测定得知,铜元素在滤液和滤渣中的质量比为4∶3(洗涤液也一起合并入滤液中),下列判断错误的是
溶液中加入11.2克Fe和Cu的混合粉末,充分反应后过滤、洗涤、干燥得34.8g滤渣和一定质量的滤液,经测定得知,铜元素在滤液和滤渣中的质量比为4∶3(洗涤液也一起合并入滤液中),下列判断错误的是
A.滤渣中不含铁
B.11.2克Fe和Cu的混合粉末中,铜的质量分数为40%
C.向滤液中加入稀盐酸没有沉淀产生
D.原![]() 溶液的溶质质量分数是10.2%
溶液的溶质质量分数是10.2%
【答案】B
【解析】
滤液中含有铜元素,说明铜与银离子发生了置换反应,铁的活泼性大于铜,可知此时铁应该已经完全反应,没有剩余,滤渣的组成为银和铜。
已知,铜的相对原子质量为64,铁为56。设混合粉末中含有![]() 克的铁,含有
克的铁,含有![]() 克的铜。则混合粉末质量:
克的铜。则混合粉末质量:![]() ;
;
设与铁反应生成的银为m1克,与铜反应生成的银为m2克,与铁反应的硝酸银为m3克,与铜反应的硝酸银为m4克,参与置换反应的铜的质量为![]() 克,未参与反应的铜的质量为
克,未参与反应的铜的质量为![]() 克。则:
克。则:
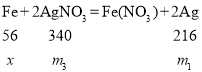
![]() ;
;![]()
![]() ;
;![]()
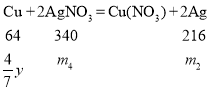
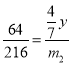 ;
;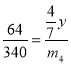
![]()
![]()
生成银的质量:![]()
滤渣的质量:![]()
联立解得:x=5.6,y=5.6,m1=21.6,m2=10.8,m3=34,m4=17
A、滤液中含有铜元素,说明铜与银离子发生了置换反应,铁的活泼性大于铜,可知此时铁应该已经完全反应,没有剩余,滤渣的组成为银和铜,故A选项正确;
B、11.2克Fe和Cu的混合粉末中,铜的质量分数![]() ,故B选项错误;
,故B选项错误;
C、铜未完全反应则说明溶液中的硝酸银已完全反应,滤液中没有银离子,向滤液中加入稀盐酸不会有沉淀产生,故C选项正确;
D、原![]() 溶液的溶质质量分数
溶液的溶质质量分数![]() ,故D选项正确。
,故D选项正确。
故本题选B。

练习册系列答案
相关题目