题目内容
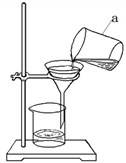
【题目】化学课外小组的同学对石灰石和稀盐酸制取二氧化碳后的废液进行溶质成分的鉴定。取废液的上层清液50克,逐滴加入溶质质量分数为10.6%的碳酸钠溶液,出现气泡,滴加至20g时不再产生气泡,开始出现白色沉淀,继续滴加至沉淀不再产生,过滤,测得沉淀的质量为5g,并绘制了图像。
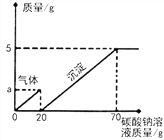
(1)通过图像可知该废液的溶质成分为__________________
(2)请计算图像中a点的数值为________。
(3)计算当碳酸钠溶液加到70g时所得溶液中溶质质量分数是_____(精确到0.1%)?
【答案】 氯化氢和氯化钙(或HCl和CaCl2) 0.88 7.2%
【解析】(1)制取二氧化碳反应后的废液,滴加Na2CO3溶液有气体放出,说明废液中有HC1,当Na2CO3溶液过量时碳酸钠和氯化钙反应产生碳酸钙白色沉淀,由此可知废液中含有的溶质为: HC1、CaCl2;(2)a点代表碳酸钠与盐酸反应产生体的质量,设碳酸钠与盐酸反应产生气体的质量为![]() ,二者生成化钠的质量为y
,二者生成化钠的质量为y
Na2CO3+ 2HC1=2NaC1+H2O+CO2↑
106 117 44
20g ![]() 10.6% y
10.6% y ![]()
![]() ,解得
,解得![]() =0.88g,y=2.34g;
=0.88g,y=2.34g;
Na2CO3+CaCl2![]() CaCO3↓+2NaCl
CaCO3↓+2NaCl
106 117
![]() z
z
![]() ,解得z=5.85g
,解得z=5.85g
当碳酸钠溶液加到70g时所得溶液中溶质质量分数是![]() 。
。

【题目】对稀硫酸的化学性质进行如下研究。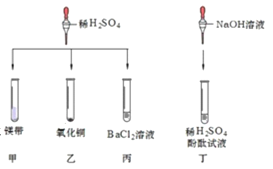
请回答下列问题:
①甲中观察到的现象是_____ ,反应的化学方程式为_________ ; 乙中反应的现象是 __________;
丙中反应的化学方程式为_____;丁中溶液由无色变成红色。
②当甲、乙试管内的固体完全溶解后,将两试管内的物质混合并加入过量的锌片、过滤,则滤渣的成分 是_________,滤液中溶质的化学式为___________。
③请设计能说明 NaOH 与H2SO4是否恰好中和的实验方案。(本题中所用过的试剂不能再用)
_______ | 实验步骤 | 实验现象 | 实验结论 |
_________ | _________ | _________ |
④实验结束后,将乙(其中固体全部溶解)、丁两个实验的废液倒入同一个干净的废液缸中,静置,最终看到上层清液呈红色,废液下层有沉淀。由此推断上层清液的成分有酚酞、水和_____。 写出生成下层沉淀物的化学方程式_____________。
通过上述实验可知,进行化学实验研究,除需要考虑生成什么物质外,还需要考虑_______。
【题目】下图为采用“数字化”实验,由传感器采集实验相关信息描绘出曲线,其中物质X表示能与二氧化碳反应的某液体,纵坐标Y表示烧杯中的某个量。下列对物质X与纵坐标Y的分析正确是
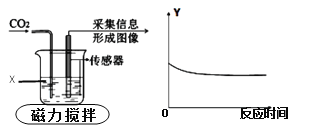
选项 | 物质X | 纵坐标Y |
A | 水 | 溶液的质量 |
B | 水 | 溶液的pH |
C | 氢氧化钠溶液 | 溶质的质量 |
D | 氢氧化钙溶液 | 溶液中钙元素质量 |
A. A B. B C. C D. D