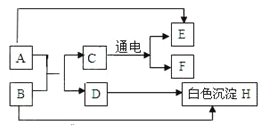
题目内容
【题目】某同学为了探究相关金属的性质,做了下列实验:

① A 中现象______;B 中反应的基本类型是______反应。
② 通过 A 和 B 实验不能证明铁、铜、银三种金属的活动性强弱,需补充一个实验达到 实验目的,写出该反应的化学方程式为______。
③ 实验 C 中物质充分反应后,猜想试管中溶液的溶质是
Ⅰ. Fe(NO3)2、Cu(NO3)2、AgNO3 Ⅱ. Fe (NO3)2、AgNO3 Ⅲ.Fe (NO3)2、Cu(NO3)2 Ⅳ.________。 其中只有一个不合理的猜想是_______。(填编号)
④ 进行定量实验可确定猜想。

操作Ⅰ是______。根据数据分析,③中猜想______成立(填编号)。
【答案】 铁片表面有红色固体析出 置换 Cu+2AgNO3 2Ag+Cu(NO3)2 Fe (NO3)2 Ⅱ 过滤 Ⅰ或 Ⅲ
【解析】①A中铁与硝酸铜反应生成硝酸亚铁和铜,所以铁片表面有红色固体析出,溶液由蓝色变为浅绿色;B 中铁与硝酸银反应生成硝酸亚铁和银,反应的基本类型是置换反应;
②A中铁与硝酸铜反应生成硝酸亚铁和铜,证明金属活动性铁大于铜;B 中铁与硝酸银反应生成硝酸亚铁和银,证明金属活动性铁大于银;所以还需要比较铜、银的活动性,可以将铜片加入硝酸银溶液中,化学方程式为:Cu+2AgNO3 2Ag+Cu(NO3)2;
③由于金属活动性铁>铜>银,根据金属活动性,铁首先与硝酸银反应,硝酸银被完全置换后,铁开始与硝酸铜进行置换反应;所以反应后溶液的溶质可能为:Fe(NO3)2、Cu(NO3)2、AgNO3; Fe (NO3)2、Cu(NO3)2;Fe (NO3)2;其中猜想Ⅱ不合理,因为在置换完银之前,铁不会与硝酸铜反应;
④操作Ⅰ将固体和液体分开,是过滤操作;根据方程式的质量关系,Fe+2AgNO3 2Ag+Fe(NO3)2;56份质量的铁恰好置换216份质量的银,根据数据分析,铁只与硝酸银反应,可能铁不足,也可能恰好与硝酸银反应,所以试管中溶液的溶质是Fe(NO3)2、Cu(NO3)2、AgNO3; Fe (NO3)2、Cu(NO3)2。

 名校课堂系列答案
名校课堂系列答案【题目】Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
加入稀硫酸的质量(g) | 充分反应后剩余固体的质量(g) | |
第1次 | 20 | 17.4 |
第2次 | 20 | 14.8 |
第3次 | 20 | 12.2 |
第4次 | 20 | 12.0 |
第5次 | 20 | m |
试回答下列问题:
(1)上述表格中m的值为_____________;
(2)黄铜样品中锌的质量分数为_________;
(3)所用稀硫酸中溶质的质量分数是__________?
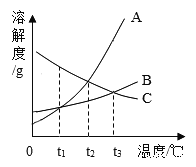
【题目】海洋中蕴藏着丰富的化学资源,如NaCl、MgCl2、CaCl2等物质。从海水中提取金属镁的主要流程如下:

(1)电解熔融的无水MgCl2可以得到金属镁。该反应属于基本反应类型中的 反应。
(2)将海水中的镁提取出来,首先要让海水中的镁离子形成沉淀而富集起来。结合表中数据分析,为了使氯化镁转化为沉淀,应加入溶液A可能是 。
室温下几种物质的溶解度
物质 | MgCO3 | CaCO3 | Mg(OH)2 | Ca(OH)2 |
溶解度/g | 0.01 | 0.0013 | 0.0029 | 0.16 |

(3)结合MgCl2的溶解度曲线分析,操作I:蒸发浓缩、 、过滤。
【题目】根据下表回答问题:
温度(℃) | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 100℃ | |
溶解度 (g/100g 水) | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 246 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 39.8 | |
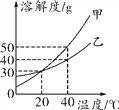
① 20℃时,50 克水中最多能溶解 NaCl______ g。
② 将硝酸钾的不饱和溶液转化为饱和溶液的方法________。(任写一种方法)若硝酸钾溶液中混有少量氯化钠,可通过______的方法提纯。
③ 硝酸钾和氯化钠溶解度相同的温度范围为______。(填编号)
I. 0℃-10℃ II. 10℃-20℃ III. 20℃-30℃ IV. 30℃-40℃
④ 30℃时,在两个各盛有 100 克水的烧杯中,分别加入相同质量的硝酸钾和氯化钠,充分溶解后,其结果如图所示。
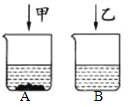
I. 两烧杯中的溶质质量分数大小关系为 A________ B。(填“>”“<”或“=”)
II. 加入的甲物质是________。
III. 对 B 中乙溶液的分析,正确的是______。
a. 加水,溶质质量分数一定变小
b. 一定是该温度下的不饱和溶液
c. 溶解的固体质量一定大于 36.3g,小于 45.8g d. 降温至 10℃,一定有晶体析出