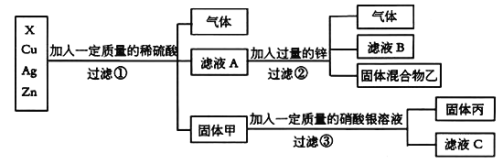
题目内容
【题目】(5分)阅读下面科普短文。
钠是一种活泼金属,其原子的结构示意图为![]() 。钠在空气中极易被氧化,用小刀一切,就能观察到它的本来面目:银白色有金属光泽。钠还能与水反应,生成氢氧化钠和氢气。
。钠在空气中极易被氧化,用小刀一切,就能观察到它的本来面目:银白色有金属光泽。钠还能与水反应,生成氢氧化钠和氢气。
目前,世界上多数采用电解熔融氯化钠的方法来制得金属钠。氯化钠的熔点为801℃,将氯化钠和氯化钙按质量比2:3混合共熔,可得到熔融温度约为580℃的共熔物,降低了电解所需的温度。电解时,正极放出氯气,负极产生的金属钠和金属钙同时浮在共熔物,从管道溢出。把熔融的金属混合物冷却到105~110℃,金属钙结晶析出,通过过滤可以分离出金属钠。
金属钠的应用非常广泛,可以用于制造过氧化钠(Na2O2)等化合物。还能用于生产更加昂贵的金属钾,以钠和氯化钾为原料,在高温条件下,生成钾和氯化钠,生成的钾能以蒸汽的形式分离出来。
依据文章内容,回答下列问题:
(1)在钠的原子结构中,与钠元素化学性质密切相关的是__________。
(2)钠具有的物理性质有__________。
(3)金属钠通常保存在石蜡油中,目的是隔绝__________。
(4)钠能与水反应,化学方程式为__________。
(5)写出用钠制取钾的化学方程式__________。
【答案】(1)最外层电子
(2)银白色固体(有金属光泽、质地软)
(3)隔绝水和氧气
(4)2Na+ 2H2O 2NaOH + H2↑
(5)Na+ KCl ![]() NaCl+ K↑
NaCl+ K↑
【解析】
试题分析:(1)最外层电子数决定元素化学性质;
(2)钠的物理性质有:有金属光泽,银白色;
(3)金属钠通常保存在石蜡油中,目的是隔绝水和氧气;
(4)根据题目信息可知,钠与水反应,生成氢氧化钠和氢气;
(5)钠与氯化钾在高温条件下生成氯化钠和钾。

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目