题目内容
【题目】(6分)在学习碱的化学性质时,某小组同学进行了如图所示的实验。
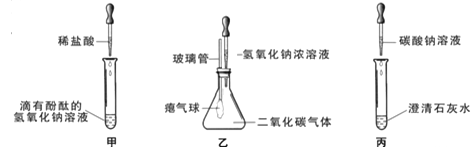
Ⅰ.探究碱的化学性质
①实验甲,随着稀盐酸的不断滴入,观察到溶液由红色变为无色;
②实验乙滴加氢氧化钠溶液后,观察到的气球变鼓;
③实验丙观察到试管内有白色沉淀产生,发生反应的化学方程式为(1)。
Ⅱ.探究废液成分
实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,由此产生疑问。
【提出问题】废液中含有哪些物质?
【查阅资料】BaCl2溶液呈中性且Na2CO3 +BaCl2 ==BaCO3↓ +2NaCl
【讨论交流】
①废液中一定含有的物质:碳酸钙、指示剂、水和(2);
②还含有能使废液呈碱性的物质,同学们有如下猜想:
猜想1:碳酸钠;
猜想2:氢氧化钠;
猜想3:氢氧化钠和碳酸钠;
猜想4:氢氧化钠和氢氧化钙。
【查阅资料】BaCl2溶液呈中性,Na2CO3+BaCl2=BaCO3↓+2NaCl
【实验设计】
同学们认为需要先验证猜想4是否成立,所需要的试剂是(3)。
若猜想4不成立,则需要进行后续实验,请你完成表格。
实验操作预计现象预计结论
_______(4)___________________(5)__________猜想1正确
若没有白色沉淀,溶液呈红色猜想2正确
_________(6)____________猜想3正确
【进行实验】同学们进行实验,通过观察实验现象,得出了猜想2成立。
【反思拓展】分析化学反应后所得物质成分时,除考虑生成物外还需考虑反应物是否有剩余。
【答案】(1)Na2CO3 +Ca(OH)2 ===CaCO3↓ +2NaOH
(2)氯化钠或NaCl
(3)碳酸钠溶液或二氧化碳
实验内容预计现象
(4)取少量废液缸中上层清液于试管中,加入过量氯化钡溶液,静置。(5)有白色沉淀,溶液无色
(6)有白色沉淀,溶液呈红色
【解析】
试题分析:Ⅰ.探究碱的化学性质(1)碳酸钠与氢氧化钙反应,生成碳酸钙和氢氧化钠;Ⅱ.探究废液成分氢氧化钠与盐酸反应,生成氯化钠和水,则①废液中一定含有的物质:碳酸钙、指示剂、水和氯化钠;
【实验设计】碳酸钠与氢氧化钙反应,生成碳酸钙和水,或二氧化碳与氢氧化钙反应,生成白色沉淀,同时溶液呈红色,则同学们认为需要先验证猜想4是否成立,所需要的试剂是碳酸钠或二氧化碳;若猜想4不成立,则(4)取少量废液缸中上层清液于试管中,加入过量氯化钡溶液,静置。(5)若产生白色沉淀,溶液为无色,则猜想1正确;(6)若产生白色沉淀,溶液呈红色,则猜想3正确。

【题目】(3分)氯化铵溶液在工农业生产中有着广泛的应用。
某同学向100g水中不断加入固体氯化铵或改变温度,得到相应的溶液①~⑤。
![]()
![]() ①
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤
资料:氯化铵的溶解度 | |||||
温度/℃ | 20 | 30 | 40 | 50 | 60 |
溶解度/g | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
试回答:
(1)氯化铵溶液中,溶质是_________。
(2)上述溶液①~⑤中,属于饱和溶液的是___________。[填序号]
(3)上述溶液①~⑤中,溶质质量分数最大的是_________。