题目内容
【题目】(8分)化学实验室要从X、银、铜、锌四种金属混合物中分离某贵重金属。流程如下:(未做特别说明的“固体”,可能为纯净物或混合物)
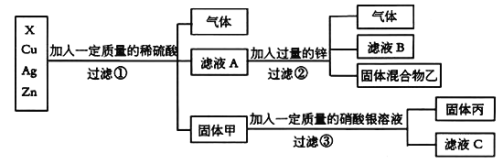
(1)四种金属的活动性由强到弱的顺序是 ;
(2)过滤操作中用到的玻璃仪器有烧杯、漏斗和 ,其作用是 ;
(3)滤液A中共含有 种溶质,固体丙中一定含有的金属是 ;
(4)写出③中反应的化学方程式 ;
(5)为了检验滤液C中的溶质成分:向其中加入稀盐酸,有白色沉淀产生,则滤液C中一定含有的阳离子 (填离子符号)。
【答案】(1)Zn > X > Cu > Ag (2)玻璃棒;引流
(3) 3;Ag
(4) Cu + 2AgNO3 === Cu(NO3)2 + 2Ag;(5)Ag+、Cu2+
【解析】
试题分析:根据金属活动性顺序的应用:位于氢前面的金属能将酸中的氢置换出来生成氢气,位于氢后面的金属不能与酸反应。由于铜和银位于氢的后面,故固体甲中一定含有铜和银;根据流程,向滤液A中加入过量的锌,若X不能与酸反应,那么加入过量的锌得到的固体中一定只含有锌,现得到的是固体混合物,说明X位于锌的后面且能与硫酸反应,即位于氢的前面,那么四种金属的活动性由强到弱的顺序是Zn > X > Cu > Ag;由于滤液A中加入锌生成了气体,故加入的稀硫酸是过量的,故滤液A中有硫酸、硫酸锌和硫酸X三种溶质;甲中含与铜和银,铜和硝酸银反应生成银和硝酸铜,故固体丙中一定含有银,可能含有铜;滤液C中中加入稀盐酸生成白色沉淀,说明滤液C中含有硝酸银,即含有银离子,同时还含有生成的硝酸铜,即:含有铜离子。

练习册系列答案
相关题目