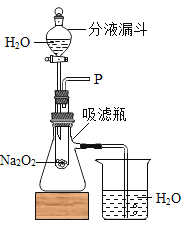
题目内容
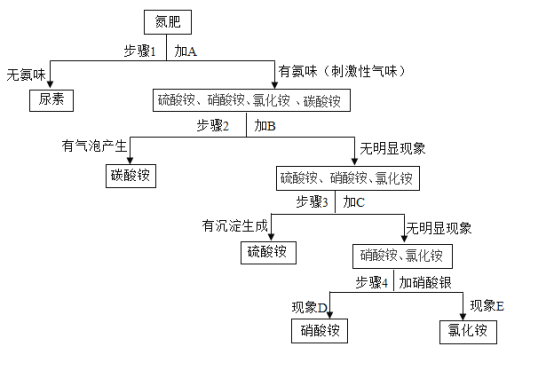
【题目】某废水中含有AgNO3、Ca(NO3)2、Fe(NO3)2、Cu(NO3)2、NaNO3几种物质。为了回收金属,同时得到较纯的硝酸钠,保护环境,化学小组的同学设计了一个处理该废水的实验方案,流程如下:
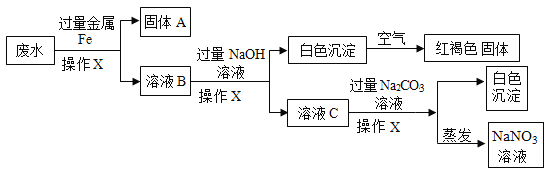
[查阅资料]白色的Fe(OH)2沉淀在潮湿空气中会迅速转化为红褐色的Fe(OH)3。
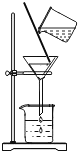
(1)操作X的名称是_______。
(2)操作中加入过量金属Fe,用铁粉末比铁片更好,其原因是_____,加入过量金属Fe可以除去废水中的______。
(3)溶液C中含有的阴离子有______。
(4)写出白色的Fe(OH)2沉淀转化为红褐色Fe(OH)3反应的化学方程式:______。
(5)化学兴趣小组对以上流程得到的NaNO3液进行检测,分析后可知得到的NaNO3溶液不纯,含有杂质,则最后得到的NaNO3溶液所含的杂质是_____。
【答案】过滤 增大反应物接触面积,充分反应 AgNO3、Cu(NO3)2 NO3-、OH- 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Na2CO3、NaOH
【解析】
(1)操作X将混合物分离得到固体和溶液,所以操作X是过滤。
故填:过滤。
(2)铁粉优点是增大反应物间的接触面积,使反应更快、更充分,铁的活动性较银和铜强,可将银和铜从它们的化合物溶液中置换出来,所以加入过量的铁粉可除去硝酸银和硝酸铜。
故填:增大反应物接触面积,充分反应;AgNO3、Cu(NO3)2。
(3)溶液B中的溶质是硝酸亚铁、硝酸钠和硝酸钙,加入过量的氢氧化钠后,硝酸亚铁转化为氢氧化亚铁,所以溶液C中含有的溶质是硝酸钠、硝酸钙、氢氧化钠,对应的阴离子是硝酸根离子和氢氧根离子。故填:NO3-、OH-。
(4)氢氧化亚铁在空气中转化为氢氧化铁,反应物中一定有氢氧化亚铁,生成物是氢氧化铁,分析可知,该反应的反应物为氢氧化亚铁、水和氧气,生成物为氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
故填:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(5)由于加入的氢氧化钠和碳酸钠均过量,后续操作中对过量的氢氧化钠和碳酸钠未进行处理,所以最终所得硝酸钠溶液中还有碳酸钠和氢氧化钠。
故填:Na2CO3、NaOH。

【题目】冬季雾霾频发。某校社会实践小组的同学们,对某地区雾霾的成分、成因、危害及防治产生了浓厚的兴趣并开启了项目性学习之旅。
[信息检索]雾是浮游在空中的大量微小水滴。霾是可吸入颗粒物浓度较高造成的能见度较低的现象。霾的主要成分肯含有可溶性硫酸盐、硝酸盐、铵盐、不溶性有机物、黑碳、金属元素和其它元素。
[提出问题]探究霾中是否含有黑碳
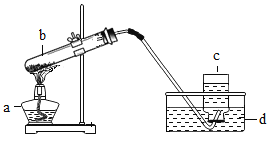
活动:同学们设计了如图所示的创新实验。( 图中残渣为霾的样品)
[实验步骤]①滴入过氧化氢溶液制取O2,排出装置内空气后,再在导管口接上气球。
②向右边的凹槽内滴入澄清的石灰水。
③接通电源,用用热电阻丝点燃残渣。
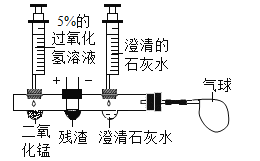
[实验现象]残渣剧烈燃烧,澄清石灰水浑浊,气球变大。
上述现象中澄清石灰水变浑浊的方程式是____,针对上述活动你得到的结论是_____,理由是_________。
[交流研讨][能力发展]请你联系实际填写关于雾霾的问卷调查表:
项目 | 雾霾频发的成因 | 控制雾霾频发的做法 | 政府采取的应急措施 |
① | 能源结构不同 | 推广太阳能发电 | 人工降雨 |
② | 烧散煤取暖 | _________ | 向空中或地面洒水 |
③ | _____________ | 推广新能源汽车 | 私家车限号出行 |