题目内容
80℃时硫酸铜溶解度为55克(克/100)克水.现有50克14.8%的硫酸铜溶液和5克38.7%的硫酸铜溶液,把这两种溶液混合,并要使混合后的溶液在80℃时成为饱和溶液.问:
(1)可采用哪些措施?
(2)如果试剂只有CuSO4?5H2O,请按所采取的措施分别进行计算得出结论.(计算结果精确到0.1克)
(1)可采用哪些措施?
(2)如果试剂只有CuSO4?5H2O,请按所采取的措施分别进行计算得出结论.(计算结果精确到0.1克)
(1)将不饱和溶液转化为饱和溶液的方法为:加入溶质或是蒸发溶剂;所以在本题中可以加入硫酸铜、硫酸铜晶体或是加热蒸发掉一部分水后在降温到80℃而将80℃时的不饱和溶液变为饱和溶液;
(2)在80℃时硫酸铜的溶解度为55g,根据溶解度的意义可以知道:在80℃时100g水中溶解了55g硫酸铜即达到了饱和,故可以据此求解溶质的质量分数,此时的溶质的质量分数即为饱和溶液的质量分数,即:
×100%=35.5%,可以据此求出加入的水或是硫酸铜晶体的质量;
将题给的两种溶液混合后溶质的质量为:50g×14.8%+5g×38.7%=9.335g.溶液的质量为:50g+5g=55g;
设蒸发掉水的质量为x
×100%=35.5%
解得 x=28.7g
硫酸铜晶体中硫酸铜的质量分数为:
×100%=64%
设需加入硫酸铜晶体的质量为y
×100%=35.5%
解得:y=35.8g
故答案为:(1)①加入CuSO4;或CuSO4?5H2O;②加热蒸发一部分水,再降温至80℃.
(2)用蒸发溶剂的方法需蒸发28.7克水;用增加溶质的方法需增加35.8克CuSO4?5H2O.
(2)在80℃时硫酸铜的溶解度为55g,根据溶解度的意义可以知道:在80℃时100g水中溶解了55g硫酸铜即达到了饱和,故可以据此求解溶质的质量分数,此时的溶质的质量分数即为饱和溶液的质量分数,即:
| 55g |
| 100g+55g |
将题给的两种溶液混合后溶质的质量为:50g×14.8%+5g×38.7%=9.335g.溶液的质量为:50g+5g=55g;
设蒸发掉水的质量为x
| 9.335g |
| 55g-x |
解得 x=28.7g
硫酸铜晶体中硫酸铜的质量分数为:
| 64+32+16×4 |
| 64+32+16×4+5×18 |
设需加入硫酸铜晶体的质量为y
| 9.335g+y?64% |
| 9.335g+y |
解得:y=35.8g
故答案为:(1)①加入CuSO4;或CuSO4?5H2O;②加热蒸发一部分水,再降温至80℃.
(2)用蒸发溶剂的方法需蒸发28.7克水;用增加溶质的方法需增加35.8克CuSO4?5H2O.

练习册系列答案
相关题目
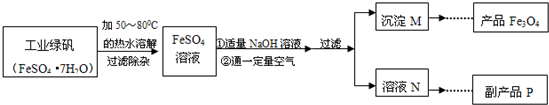
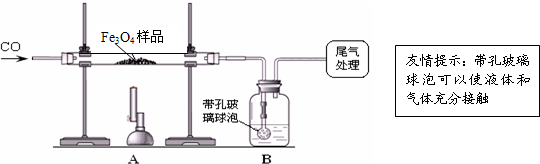
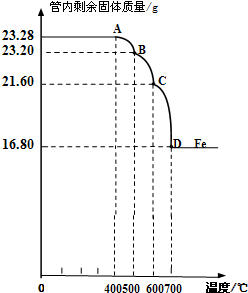 质量差会偏小而影响计算、分析,你认为他们的理由是
质量差会偏小而影响计算、分析,你认为他们的理由是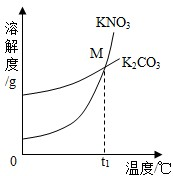 (2013?历城区二模)(1)K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图.
(2013?历城区二模)(1)K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图.