题目内容
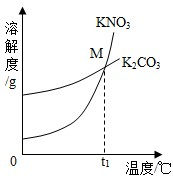 (2013?历城区二模)(1)K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图.
(2013?历城区二模)(1)K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图.| 温度/℃ | 20 | 30 | 50 | 60 | 80 | |
| 溶解度/g | K2CO3 | 110 | 114 | 121 | 126 | 139 |
| KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 | |
变大
变大
(填“变大”、“变小”或“不变”).②曲线上M点的含义是
t1℃时甲、乙的溶解度相等(合理说法均可)
t1℃时甲、乙的溶解度相等(合理说法均可)
.(2)某课外活动小组利用废铜制取硫酸铜,设计了如下两个方案:
方案一:Cu→CuO
| 稀硫酸 |
| △ |
方案二:②Cu
| 浓硫酸 |
| △ |
| ||
从绿色化学的观点出发,你认为方案
一
一
更合理,简述原因不产生有害气体,保护环境(合理均可)
不产生有害气体,保护环境(合理均可)
.分析:(1)①据30℃时K2CO3的溶解度,其溶解度随温度变化情况,及饱和溶液中溶质的质量分数计算式分析解答;
②溶解度曲线的交点表示该温度下两物质的溶解度相等;
(2)绿色化学是指原料利用率高、操作简单、对环境无污染,据此并 结合两种实验方案的原理分析解答.
②溶解度曲线的交点表示该温度下两物质的溶解度相等;
(2)绿色化学是指原料利用率高、操作简单、对环境无污染,据此并 结合两种实验方案的原理分析解答.
解答:解:(1)①30℃时K2CO3的溶解度是114g,所以向124g K2CO3固体中加入100g水,充分溶解后得到的是该温度下的饱和溶液,且剩余溶质10g,观察图表和溶解度曲线图可知:K2CO3的溶解度随温度的升高而增大,50℃时其溶解度是121g,故升温至40℃,固体继续溶解,仍然是饱和溶液,所以溶液中溶质的质量分数变大;
②曲线上M点表示:t1℃时,甲、乙两种物质的溶解度相等;
(2)由反应可知:方案一:2Cu+O2
2CuO;CuO+H2SO4(稀)═CuSO4+H2O,方案二:Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑,制取相同量的硫酸铜时,方案二消耗的硫酸比方案一多,并且制取过程中产生了污染大气的有毒气体SO2,所以方案二不可取,而方案一即节约了原料,又不污染环境;
故答案为:(1)①变大;
②t1℃时,甲、乙两种物质的溶解度相等;(合理说法均可);
(2)一;不产生有害气体,保护环境(合理均可).
②曲线上M点表示:t1℃时,甲、乙两种物质的溶解度相等;
(2)由反应可知:方案一:2Cu+O2
| ||
| ||
故答案为:(1)①变大;
②t1℃时,甲、乙两种物质的溶解度相等;(合理说法均可);
(2)一;不产生有害气体,保护环境(合理均可).
点评:本题考查了学生依据溶解度曲线分析和解决问题的能力,以及对实验方案的分析和评价,注意平时知识的积累是解题的关键所在.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
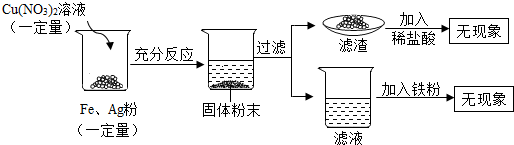
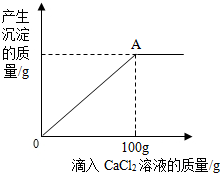 (2013?历城区二模)小丽同学利用一瓶敞口放置已久的NaOH溶液进行了一些实验探究.
(2013?历城区二模)小丽同学利用一瓶敞口放置已久的NaOH溶液进行了一些实验探究.