题目内容
80℃时硫酸铜溶解度为55克(克/100)克水.现有50克14.8%的硫酸铜溶液和5克38.7%的硫酸铜溶液,把这两种溶液混合,并要使混合后的溶液在80℃时成为饱和溶液.问:(1)可采用哪些措施?
(2)如果试剂只有CuSO4?5H2O,请按所采取的措施分别进行计算得出结论.(计算结果精确到0.1克)
分析:(1)根据饱和溶液和不饱和溶液相互转化方法来解答该题;
(2)根据所判断出来的转化方法结合溶质的质量分数的计算公式来计算得出正确的结论.
(2)根据所判断出来的转化方法结合溶质的质量分数的计算公式来计算得出正确的结论.
解答:解:(1)将不饱和溶液转化为饱和溶液的方法为:加入溶质或是蒸发溶剂;所以在本题中可以加入硫酸铜、硫酸铜晶体或是加热蒸发掉一部分水后在降温到80℃而将80℃时的不饱和溶液变为饱和溶液;
(2)在80℃时硫酸铜的溶解度为55g,根据溶解度的意义可以知道:在80℃时100g水中溶解了55g硫酸铜即达到了饱和,故可以据此求解溶质的质量分数,此时的溶质的质量分数即为饱和溶液的质量分数,即:
×100%=35.5%,可以据此求出加入的水或是硫酸铜晶体的质量;
将题给的两种溶液混合后溶质的质量为:50g×14.8%+5g×38.7%=9.335g.溶液的质量为:50g+5g=55g;
设蒸发掉水的质量为x
×100%=35.5%
解得 x=28.7g
硫酸铜晶体中硫酸铜的质量分数为:
×100%=64%
设需加入硫酸铜晶体的质量为y
×100%=35.5%
解得:y=35.8g
故答案为:(1)①加入CuSO4;或CuSO4?5H2O;②加热蒸发一部分水,再降温至80℃.
(2)用蒸发溶剂的方法需蒸发28.7克水;用增加溶质的方法需增加35.8克CuSO4?5H2O.
(2)在80℃时硫酸铜的溶解度为55g,根据溶解度的意义可以知道:在80℃时100g水中溶解了55g硫酸铜即达到了饱和,故可以据此求解溶质的质量分数,此时的溶质的质量分数即为饱和溶液的质量分数,即:
| 55g |
| 100g+55g |
将题给的两种溶液混合后溶质的质量为:50g×14.8%+5g×38.7%=9.335g.溶液的质量为:50g+5g=55g;
设蒸发掉水的质量为x
| 9.335g |
| 55g-x |
解得 x=28.7g
硫酸铜晶体中硫酸铜的质量分数为:
| 64+32+16×4 |
| 64+32+16×4+5×18 |
设需加入硫酸铜晶体的质量为y
| 9.335g+y?64% |
| 9.335g+y |
解得:y=35.8g
故答案为:(1)①加入CuSO4;或CuSO4?5H2O;②加热蒸发一部分水,再降温至80℃.
(2)用蒸发溶剂的方法需蒸发28.7克水;用增加溶质的方法需增加35.8克CuSO4?5H2O.
点评:知道饱和溶液和不饱和溶液的转化方法,熟练掌握饱和溶液的溶质质量分数的求算方法,理解溶解度的意义,能够根据溶解度求出饱和溶液的质量分数.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
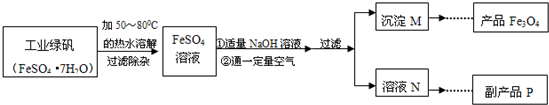
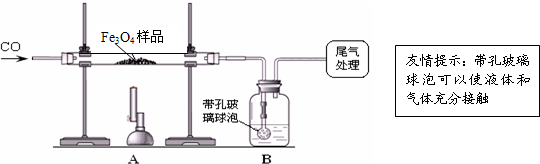
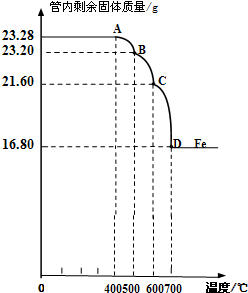 质量差会偏小而影响计算、分析,你认为他们的理由是
质量差会偏小而影响计算、分析,你认为他们的理由是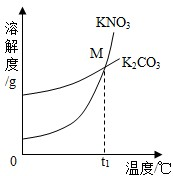 (2013?历城区二模)(1)K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图.
(2013?历城区二模)(1)K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图.