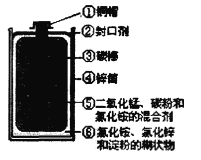
��Ŀ����
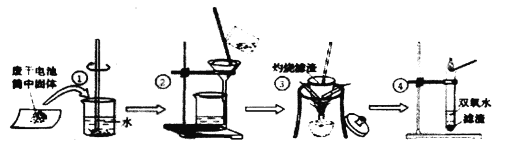
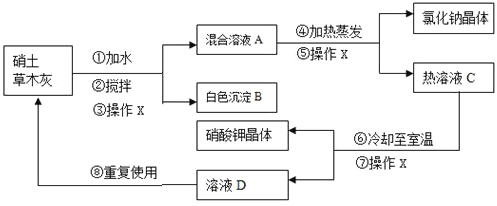
����Ŀ����������������Ͳ�ľ����ԭ������ȡ����أ������к�������ƺ��Ȼ������ʣ���ľ�ҵ���Ҫ�ɷ���̼��أ������Ĺ���������Ҫ��ͼ��ʾ��
��1���ۢݢ���Ϊ����X���ò����� ��
��2�����ͼ�����������������ü������������õ��Ȼ��ƾ��壬������ȴ�ᾧ���õ�����ؾ����ԭ�� ��
��3��д�����ɰ�ɫ����B�Ļ�ѧ����ʽ�� ��
��4���ú������Ϊ50%������40kg���ľ�һ�ϣ��������������̣�����������ȡ����ص������� kg������1λС������
��5����ҺD�����ظ�ʹ�õ�ԭ���� ��
���𰸡�������
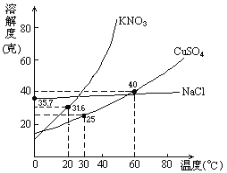
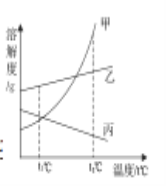
��NaCl���ܽ�����¶ȱ仯��Ӱ���С����KNO3���ܽ�����¶ȱ仯��Ӱ��ϴ�
��Ca��NO3��2+K2CO3�TCaCO3��+2KNO3
�� 24.6
����Һ�����н϶��KNO3
��������
��������������к�������ƺ��Ȼ������ʣ���ľ�ҵ���Ҫ�ɷ���̼��أ���ˮ���裬�������̼��ط�Ӧ����̼��Ƴ���������أ��������ˡ�����̼��Ƴ������Ȼ��ƺ�����ػ����ҺA���������������ˡ����Ȼ��ƺ�����ҺC����أ����������Һ��ȴ�����¡����ˡ�������ؾ������ҺD������Ϊ����أ����ٻ���������
��1���ۢݢ���Ϊ����X���ò����ǽ������Һ��ֿ���Ϊ������
��2�����ܽ�ȵ�����ͼ��֪��NaCl���ܽ�����¶ȱ仯��Ӱ���С���ü������������õ��Ȼ��ƾ��壻��KNO3���ܽ�����¶ȱ仯��Ӱ��ϴ�����ȴ�ᾧ���õ�����ؾ��壻
��3�������к�������ƺ��Ȼ������ʣ���ľ�ҵ���Ҫ�ɷ���̼��أ���ˮ���裬�������̼��ط�Ӧ����̼��Ƴ���������أ���ȷ��д�˷�Ӧ�Ļ�ѧ����ʽ��
��4����֪�����Ϊ50%������40kg���������Ϊ20kg�����ݻ�ѧ����ʽCa��NO3��2+K2CO3�TCaCO3��+2KNO3���÷�Ӧ�������ȿ��������������ȡ����ص�������
��5�����������Һ��ȴ֪���µ�����ؾ������ҺD������Ϊ����أ�����ҺD���н϶����������ʿ��ظ����á�

 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д�