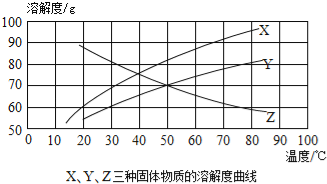
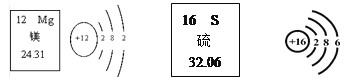
题目内容
【题目】现将10克A和足量B混合加热,A和B发生化学反应,10克A完全反应后生成8克C和4克D,则参加反应的A 和B 的质量比是:
A. 1:1 B. 2:1 C. 4:1 D. 5:1
【答案】D
【解析】试题分析:据质量守恒定律可知,化学反应前后物质的总质量不变,A与B发生化学反应,10gA完全反应后生8gC和4gD,则参加反应的A与B的质量和为12g,参加反应的B的质量为2g, 参加反应的A与B的质量比为10g:2g=5:1.

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案【题目】有关物质组成及化学规律的发现对化学的发展做出了重要贡献。
(1)法国化学家拉瓦锡为化学学科的发展做出了巨大贡献,下列有关发现与他有密切关系的是_______。
A.空气的组成 B.元素周期律
C.质量守恒定律 D.原子的结构
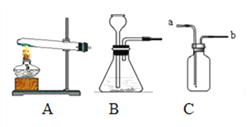
(2)【实验回顾】如图所示装置可用于粗略测定空气中氧气含量。

①集气瓶内加入少量水的作用是___________ ;
②红磷燃烧结束后,冷却至室温,打开弹簧夹,水能进入集气瓶中的原因是________;
【问题提出】有实验资料表明:燃烧过程中,当氧气体积分数低于7% 时,红磷就无法继续燃烧,因此通过上述实验,测定结果与理论值误差较大。
【实验改进】
Ⅰ.根据铁在空气中生锈(铁与氧气、水发生缓慢氧化生成铁锈)的原理设计了图12所示的实验装置,再次测定空气中氧气含量。装置中饱和食盐水,活性炭会加速铁生锈。
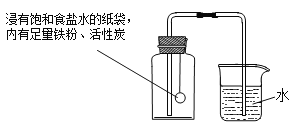
Ⅱ.测得实验数据如表
测量项目 | 实验前 | 实验后 | |
烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)和导管的容积 | |
体积/mL | 80.0 | 49.0 | 150.0 |
【交流表达】
(3)根据表中数据计算,改进实验后测得的空气中氧气的体积分数是________(计算结果精确到0.1%)。
(4)从实验原理角度分析,改进后的实验结果比前者准确度更髙的原因是:
①铁的缓慢氧化使集气瓶中的氧气消耗更彻底,使实验结果更准确。
②____________。
【查阅资料】镁条除了和氧气反应,还可以和氮气、二氧化碳发生反应。
【问题拓展】镁条能在空气中燃烧,镁与氧气反应的化学方程式为________。探究空气中氧气含量的实验中(见图11),若将燃烧匙中的药品换成镁粉,其它操作均正确,实验结束后,测量得到的结果____________(填“偏大”、“偏小”或“无影响”)。