题目内容
【题目】同学们用“硝酸钡、氢氧化钡、碳酸钾”三种物质的溶液进行实验。
(1)甲组同学用______测得碳酸钾溶液的pH大于7,同学们因此推理得知:呈碱性的溶液不一定是碱的溶液。
(2)乙组同学按如图所示进行实验,此时观察到的实验现象是______,请写出其中一个反应的化学方程式________。实验完毕,充分振荡U形玻璃管,将管内的物质过滤。同学们对滤液成分进行了进一步的探究。
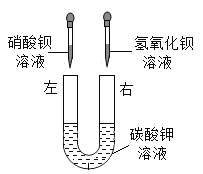
(提出问题)滤液中除K+,还含有什么离子?
(作出猜想)猜想一:含有OH-、NO3-、CO32-
猜想二:含有Ba2+、______(填离子符号)
猜想三:含有OH-、NO3-
(实验探究)
实验操作 | 实验现象 | 结论 |
取滤液于试管中,向其中滴加少量的硫酸钠溶液 | 无明显现象 | 猜想一正确 |
(评价与交流)
(1)你认为乙组同学们的结论________(填“正确”或“不正确”),理由是________。
(2)同学们经过讨论后一致认为:若将硫酸钠溶液换成足量的________,就能确定滤液中的离子成分。
【答案】pH试纸 U形玻璃管左、右两端均产生白色沉淀 ![]() 或
或![]() OH-、NO3- 不正确 当加入硫酸钠溶液,猜想三也无明显现象 稀硫酸
OH-、NO3- 不正确 当加入硫酸钠溶液,猜想三也无明显现象 稀硫酸
【解析】
(1)可以用pH试纸测定溶液的pH值;
(2)硝酸钡能与碳酸钾反应生成碳酸钡和硝酸钾,该反应的化学方程式为:![]() ,氢氧化钡能与碳酸钾反应生成碳酸钡和氢氧化钾,该反应的化学方程式为:
,氢氧化钡能与碳酸钾反应生成碳酸钡和氢氧化钾,该反应的化学方程式为:![]() ;故观察到的实验现象是:U型玻璃管左、右两端均产生白色沉淀,化学方程式为:
;故观察到的实验现象是:U型玻璃管左、右两端均产生白色沉淀,化学方程式为:![]() 或
或![]() ;
;
作出猜想:![]() ,
,![]() ,当碳酸钾过量时,溶液中含有OH-、NO3-、CO32-,当硝酸钡或氢氧化钡过量时,溶液中除K+,还含有OH-、NO3-、Ba2+,当硝酸钡、氢氧化钡与碳酸钾完全反应时,溶液中除K+,还含OH-、NO3-,故猜想二为:OH-、NO3-、Ba2+;
,当碳酸钾过量时,溶液中含有OH-、NO3-、CO32-,当硝酸钡或氢氧化钡过量时,溶液中除K+,还含有OH-、NO3-、Ba2+,当硝酸钡、氢氧化钡与碳酸钾完全反应时,溶液中除K+,还含OH-、NO3-,故猜想二为:OH-、NO3-、Ba2+;
评价与交流:取滤液于试管中,向其中滴加少量的硫酸钠溶液,无明显现象,说明溶液中不含钡离子,但是不能说明猜想一正确,因为当加入硫酸钠溶液,猜想三也无明显现象,故填:不正确;当加入硫酸钠溶液,猜想三也无明显现象;
若将硫酸钠溶液换成足量的稀硫酸,氢离子能与碳酸根离子生成水和二氧化碳,钡离子能与碳酸根离子生成碳酸钡沉淀,若有气泡产生,则猜想一成立,若有白色沉淀产生,则猜想二成立,若无明显现象,则猜想三成立,故填:稀硫酸。

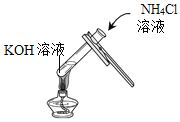
【题目】某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品,这种工业称为“氯碱工业”。 某研究性学习小组对该厂生产的烧碱样品进行如下探究:电解饱和食盐水的化学方程式为 +____↑。
+____↑。
(提出问题)烧碱样品中可能含有哪些杂质?
(猜想)猜想1:只含有Na2CO3 ;
猜想2:只含有NaCl;
猜想3:含有______。
作出猜想1的依据是_____(用化学方程式表示)。
(设计实验)
实验步骤 | 实验现象 | 解释或结论 |
Ⅰ.取适量烧碱样品于试管中,加水溶解,并用手触摸试管外壁 | 试管外壁发热 | 原因是____。 |
Ⅱ.向Ⅰ所得的溶液中逐滴加入稀硝酸至过量 | 刚开始_____,一段时间后产生能使澄清石灰水变浑浊的气体 | 猜想2不成立 |
Ⅲ.向Ⅱ所得的溶液中___。 | 产生白色沉淀 | 结合实验Ⅱ,猜想3成立 |
(交流与讨论)小坚同学提出:“上述实验Ⅱ中稀硝酸也可以用稀盐酸代替”。你认为他的观点________(选填“正确”或“不正确”),理由是_____。
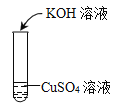
【题目】某兴趣小组在实验室中探究氢氧化钾的性质,请你参与他们的探究。
(1)[实验过程与分析]
实验一 | 实验二 | 实验三 | |
实验操作 |
|
|
|
实验现象 | _____________________ | ______________________ | 无明显现象 |
实验结论 | 氢氧化钾能与硫酸铜发生反应 | 氢氧化钾能与氯化铵发生反应 | 氢氧化钾不能与硫酸发生反应 |
实验一反应的化学方程式为_______________。
(2)[实验反思与拓展]
①某同学认为实验三的结论错误。他取适量的氢氧化钾溶液于一支干净的试管中,滴加几滴_________________,溶液呈红色,然后逐滴滴加稀硫酸,直至溶液变成___________色,证明氢氧化钾能与硫酸发生反应。
②对于无明显现象的化学反应,可通过检验有新物质生成或检验_________________的方法来证明物质间发生了化学反应。