题目内容
【题目】某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品,这种工业称为“氯碱工业”。 某研究性学习小组对该厂生产的烧碱样品进行如下探究:电解饱和食盐水的化学方程式为 +____↑。
+____↑。
(提出问题)烧碱样品中可能含有哪些杂质?
(猜想)猜想1:只含有Na2CO3 ;
猜想2:只含有NaCl;
猜想3:含有______。
作出猜想1的依据是_____(用化学方程式表示)。
(设计实验)
实验步骤 | 实验现象 | 解释或结论 |
Ⅰ.取适量烧碱样品于试管中,加水溶解,并用手触摸试管外壁 | 试管外壁发热 | 原因是____。 |
Ⅱ.向Ⅰ所得的溶液中逐滴加入稀硝酸至过量 | 刚开始_____,一段时间后产生能使澄清石灰水变浑浊的气体 | 猜想2不成立 |
Ⅲ.向Ⅱ所得的溶液中___。 | 产生白色沉淀 | 结合实验Ⅱ,猜想3成立 |
(交流与讨论)小坚同学提出:“上述实验Ⅱ中稀硝酸也可以用稀盐酸代替”。你认为他的观点________(选填“正确”或“不正确”),理由是_____。
【答案】Cl2 Na2CO3 和NaCl ![]() 氢氧化钠固体溶于水放热 无明显现象 滴加几滴硝酸银溶液 不正确 引入Cl-,干扰对NaCl的检验
氢氧化钠固体溶于水放热 无明显现象 滴加几滴硝酸银溶液 不正确 引入Cl-,干扰对NaCl的检验
【解析】
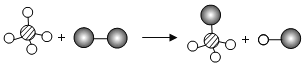
据质量守恒定律可知反应前后原子的种类、个数不变,电解饱和食盐水的化学方程式为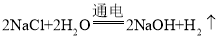 +____↑。
+____↑。
原子种类 | O | Na | Cl | H |
反应物中原子个数 | 2 | 2 | 2 | 4 |
已知生成物中原子个数 | 2 | 2 | 0 | 4 |
差值(X) | 0 | 0 | 2 | 0 |
X的化学式 | Cl2 | |||
[猜想] 烧碱样品中可能有制取烧碱时剩余的氯化钠,也可能有变质生成的碳酸钠,故猜想1:只含有Na2CO3 ;猜想2:只含有NaCl;猜想3:含有Na2CO3 和NaCl;
作出猜想1的依据是氢氧化钠和空气中的二氧化碳反应变质生成碳酸钠,化学方程式为![]() ;
;
[设计实验]
Ⅰ.取适量烧碱样品于试管中,加水溶解,并用手触摸试管外壁,试管外壁发热,原因是氢氧化钠固体溶于水放热;
Ⅱ.氢氧化钠和碳酸钠的混合物中加入酸时,氢氧化钠先和酸反应,碳酸钠后与酸反应,向Ⅰ所得的溶液中逐滴加入稀硝酸至过量,刚开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体,说明有碳酸钠,猜想2不成立;
Ⅲ.向Ⅱ所得的溶液中滴加几滴硝酸银溶液,产生白色沉淀,因氯化钠和硝酸银反应生成氯化银白色沉淀,结合实验Ⅱ,猜想3成立;
[交流与讨论]小坚同学提出:“上述实验Ⅱ中稀硝酸也可以用稀盐酸代替”。他的观点不正确,理由是使用盐酸引入Cl-,干扰对NaCl的检验。

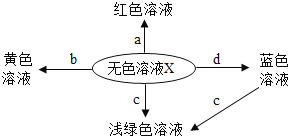
【题目】同学们用“硝酸钡、氢氧化钡、碳酸钾”三种物质的溶液进行实验。
(1)甲组同学用______测得碳酸钾溶液的pH大于7,同学们因此推理得知:呈碱性的溶液不一定是碱的溶液。
(2)乙组同学按如图所示进行实验,此时观察到的实验现象是______,请写出其中一个反应的化学方程式________。实验完毕,充分振荡U形玻璃管,将管内的物质过滤。同学们对滤液成分进行了进一步的探究。
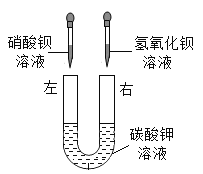
(提出问题)滤液中除K+,还含有什么离子?
(作出猜想)猜想一:含有OH-、NO3-、CO32-
猜想二:含有Ba2+、______(填离子符号)
猜想三:含有OH-、NO3-
(实验探究)
实验操作 | 实验现象 | 结论 |
取滤液于试管中,向其中滴加少量的硫酸钠溶液 | 无明显现象 | 猜想一正确 |
(评价与交流)
(1)你认为乙组同学们的结论________(填“正确”或“不正确”),理由是________。
(2)同学们经过讨论后一致认为:若将硫酸钠溶液换成足量的________,就能确定滤液中的离子成分。
【题目】分析处理信息是学习的一种重要方法,下表是氯化钠与硝酸钾在不同温度下的溶解度。这两种固体物质在水中的溶解度曲线如图所示:
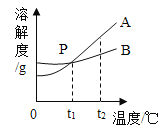
温度/℃ | 20 | 40 | 60 | 80 | |
温度/g | NaCl | 36.0 | 36.6 | 37.3 | 38.4 |
KNO3 | 31.6 | 63.9 | 110 | 169 | |
请仔细阅读图标后回答下列问题:
(1)A曲线表示的是________的溶解度曲线(选填“NaCl”或“KNO3”)。
(2)20 ℃时,100 g水中最多可溶解NaCl______________g。
(3)溶解度曲线中的t1对应的温度范围是_______________℃。
(4)向烧杯中加入100 g水和90 g硝酸钾配成60 ℃的溶液,再冷却到20 ℃,烧杯中析出固体为________g。
【题目】某化学小组为验证稀硫酸的性质,并探究反应后废液的成分,进行了如下实验。
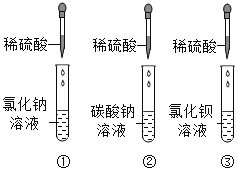
I:验证稀硫酸的某些性质
(1)按图所示进行实验,其中试管_____(选填序号)中无明显现象,小组同学讨论认为该试管中的两种物质间没有发生复分解反应,他们的理由是_____。
(2)为验证稀硫酸和氢氧化钠溶液是否发生反应,小明和小红分别向盛有氢氧化钠溶液的试管中,先加稀硫酸,再向混合后的溶液中滴加几滴酚酞溶液,结果小明观察到溶液为红色。小红观察到溶液为无色,于是二者得出了不同的结论。
小组同学在不改变所用试剂的情况下。对他们的实验方案进行了修改,从而确保实验一定能得出“硫酸与氢氧化钠溶液发生了化学反应”的结论。他们的实验方案是(只写操作过程):_____。
Ⅱ:探究反应后废液的成分
将如图所示实验后三支试管中的物质均倒入同一烧杯中,充分混合后静置,得到白色沉淀和无色溶液,用pH计测得无色溶液的pH=8.6。
(提出问题)无色溶液中溶质的成分是什么?
(作出猜想)猜想一:Na2CO3和NaCl;猜想二:H2SO4和Na2SO4;
猜想三:NaCl和Na2SO4;猜想四:Na2CO3、NaC1和Na2SO4
小组讨论认为猜想二不合理,理由是_____。
(进行实验)
实验步骤 | 实验操作 | 实验现象 | 实验结论 |
① | 取少量无色溶液于试管中。向其中滴加稀盐酸 | _____ | 猜想三不成立 |
② | 向步骤①后的溶液中加入BaCl2溶液。 | 产生白色沉淀 | 猜想四成立 |
小组同学认为“猜想四成立”这一结论是不可靠的,理由是_____。(用化学方程式表示)。
小组同学在不改变所用试剂的情况下,对实验方案进行了修改,并重新进行了实验,仍然得出“猜想四成立”的结论。他们修改后的实验方案是_____。
【题目】某实验小组对“载人宇宙飞船或潜水艇中一般都要安装盛放过氧化钠(Na2O2)颗粒的装置”感到非常好奇,设计实验进行探究。
(提出问题)过氧化钠与人呼出的哪种气体发生反应?
(查阅资料)① 人呼出的气体中主要成分是N2、O2、CO2和水蒸气等。② CO2+2NaOH=Na2CO3+H2O。
(提出猜想)过氧化钠与人呼出的N2或CO2或水蒸气反应并生成氧气。
(进行实验)实验Ⅰ:验证过氧化钠与氮气反应并生成氧气。
(1)实验操作如下图I所示。
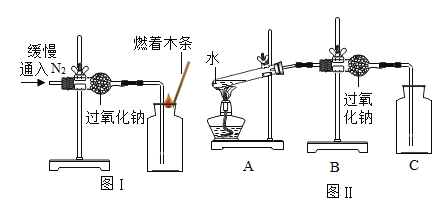
(2)实验现象及结论:观察到______现象,判断过氧化钠与氮气没有发生反应。
实验Ⅱ:验证过氧化钠与水蒸气反应并生成氧气。
(1)同学们在老师的指导下设计了如上图II所示装置。其中A装置的作用是_____,发生的变化是______变化(填“物理”或“化学”)。
(2)兴趣小组同学经查阅资料得出,过氧化钠与水蒸气发生反应并生成氧气还生成一种白色固体氢氧化钠,请写出有关化学方程式_____。
(3)实验现象及结论:带火星的木条复燃;过氧化钠与水蒸气发生反应并生成氧气。
实验Ⅲ:验证过氧化钠与二氧化碳反应并生成氧气。
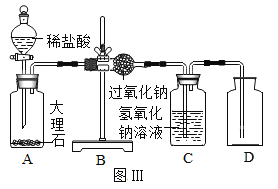
(1)同学们在老师的指导下设计了如图所示装置。
(2)实验记录
实验操作 | 主要实验现象 | 实验结论及解释 | |
① | 检查装置的气密性。向装置中加入药品。 | 装置的气密性良好。 | |
② | 打开分液漏斗活塞,向A装置中缓慢加入稀盐酸。 | A装置中观察到的现象有______,C装置中有气泡出现。 | C装置作用是__。 |
③ | 一段时间后用带火星的木条在D内进行检验。 | 带火星的木条复燃。 | 过氧化钠与二氧化碳反应并生成氧气。 |
(实验反思)
(1)根据实验Ⅱ和Ⅲ,过氧化钠与二氧化碳或水蒸气反应后,还产生了另一种物质,该物质是_____(填“单质”或“化合物”)。
(2)某同学对实验Ⅲ的设计提出疑问:该实验不能证明二氧化碳与过氧化钠确实发生了反应,你认为他的理由是_______。