题目内容
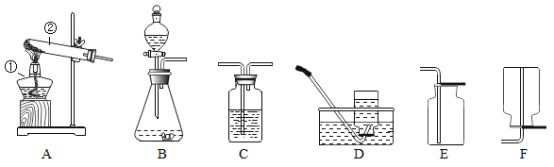
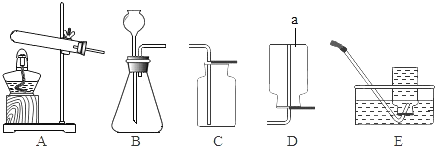
【题目】下图所示的仪器常用于实验室制取气体。请回答下列问题:
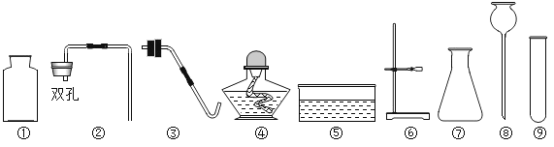
(1)仪器⑧的名称是________。
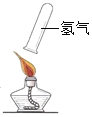
(2)欲使用高锰酸钾制取氧气,发生装置应选择的仪器组合是(填序号)________,能用排水法收集氧气的原因是________。如果要做铁丝在氧气中燃烧的实验,收集氧气时要在瓶底留一些水,其原因是________。
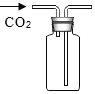
(3)实验室制取并收集二氧化碳气体,选择的仪器组合是(填序号)________,反应原理用化学方程式表示为________。
【答案】长颈漏斗 ③④⑥⑨ 氧气不易溶于水 防止高温熔融物溅落,使瓶底炸裂 ①②⑦⑧ CaCO3+2HCl=CaCl2+H2O+CO2↑
【解析】
(1)仪器⑧是长颈漏斗。故答案为:长颈漏斗;
(2)使用高锰酸钾制取氧气,固体药品高锰酸钾在加热的条件下分解出锰酸钾、二氧化锰和氧气。故应该使用固固加热法制取氧气。固固加热法制取氧气的发生装置为:铁架台、酒精灯、试管、单孔橡胶塞、导管。因为氧气的溶解性为不易溶于水,所以收集氧气可以根据此,选择排水法收集。如果要做铁丝在氧气中燃烧的实验,则收集氧气时就应该在瓶底放入少量的水,因为铁丝和氧气反应生成黑色的固体四氧化三铁,若没有铺上水,则生成的高温熔融物会溅落会使瓶底炸裂。故答案为:③④⑥⑨、氧气不易溶于水、防止高温熔融物溅落,使瓶底炸裂;
(3)实验室制取二氧化碳,利用的是固体药品碳酸钙和液体药品稀盐酸,在常温下混合制取二氧化碳,使用的是固液混合不加热法制取二氧化碳,并使用向上排空气法收集生成的二氧化碳。故需要:锥形瓶、双孔橡胶塞、长颈漏斗、集气瓶、导管。常温下,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳。故答案为:①②⑦⑧、CaCO3+2HCl=CaCl2+H2O+CO2↑。

【题目】为测定一瓶由Na2CO3 、NaOH组成的固体混合物中NaOH的质量分数,小明采用沉淀法进行如下操作:①取20克样品于烧杯中,加足量水配成溶液;②在样品溶液中加入过量的BaCl2溶液;③待反应完全后,过滤、洗涤、干燥、称量。有关数据记录如下表:
反应前 | 反应后 | |
烧杯和样品 溶液总质量/g | 加入的氯化钡 溶液质量/g | 过滤后烧杯和溶液总质量/g (滤液的损失忽略不计) |
95 | 65 | 140.3 |
请回答下列问题:
(1)反应共生成沉淀_____g,原样品中NaOH的质量分数是多少________?
(2)在反应前后的溶液中,下列元素质量保持不变的是_____。
A 钠元素 B 碳元素 C 钡元素 D 氧元素
(3)实验操作步骤③中,确定沉淀洗涤干净的方法:取最后一次洗涤液,滴加_____试剂,观察到_____现象,则已洗涤干净。