题目内容
【题目】金属材料与人类的生产和生活密切相关。请回答:
(1)下列用品中,主要利用金属导电性的是:______(填字母)。
A.铂金饰品;B.铁锅;C.铝导线;
(2)为了验证铝、铜、银三种金属的活动性顺序,设计了下列三种方案,其中可行的是:______(填序号)。
①将铝、银分别浸入到硫酸铜溶液中
②将银分别浸入到硫酸铝、硫酸铜溶液中
③将铜、银分别浸入到硫酸铝溶液中
(3)在氯化铜和氯化亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,得到滤渣和滤液。
①滤液中一定含有的溶质是:______(填化学式);可能含有的溶质是:______(填化学式)
②向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是:______(填化学式)。
(4)某钢铁厂每天需消耗4900t含Fe2O376%的赤铁矿石,该厂理论上可日产含Fe98%的生铁的质量是:______t。
【答案】C ① MgCl2 FeCl2 Fe、Cu 2660
【解析】
(1)在常见的金属材料用品中,铝导线主要利用金属导电性;
(2)①铝与硫酸铜反应,可验证铝的活动性比铜强。银与硫酸铜不反应,可知银的活动性比铜弱,可验证铝、铜、银三种金属的活动性顺序,所以①是可行的方案;
②银与硫酸铝、硫酸铜都不反应反应,可验证铝、铜的活动性比银强;与但不能验证铝、铜的活动性,不可验证铝、铜、银三种金属的活动性顺序,所以②是不可行的方案;
③铜、银与硫酸铝都不反应反应,可验证铝的活动性比铜、银强。但不能验证铜、银的活动性,不可验证铝、铜、银三种金属的活动性顺序,所以③是不可行的方案;
(3)在氯化铜和氯化亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,得到滤渣和滤液,①由于镁的活泼性大于同和铜、铁,能与氯化铜和氯化亚铁反应,则滤液中一定含有的溶质是MgCl2,不能确定氯化铜和氯化亚铁的存在;
②若向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是Fe,还有置换出的Cu,Mg不能确定是否存在;
(4)设日产含Fe98%的生铁的质量为x,
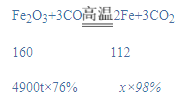
![]()
x=2660t。

【题目】控制变量、设计对比实验是常用的实验探究的重要方法。
(实验探究)
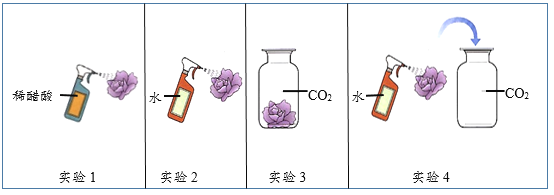
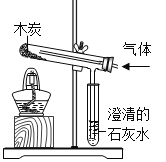
(1)如图是何军同学设计的探究物质燃烧条件的3个对比实验,分析实验:请根据各实验现象,帮助何军同学完成下列实验报告:

步骤 | 设计意图 | 实验现象 | 实验结论 |
实验一 | 燃烧与物质的关系 | ____________ | 可燃物才能燃烧 |
实验二 | ____________ | 玻璃杯内蜡烛熄灭,外面的仍燃烧 | _________ |
实验三 | 燃烧与温度的关系 | 小木条很快燃烧,小煤块很久才燃烧 | _________ |
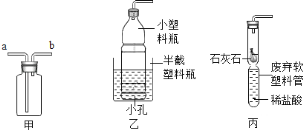
(2)何明采用如图的实验装置来探究木炭燃烧的条件。
①以下实验操作步骤能验证可燃物燃烧的两个条件,则实验操作顺序应为_____(每步仅可选用一次)。
A.通入N2 B.通入O2 C.点燃酒精灯
②由木炭在纯氧中燃烧后生成的一氧化碳和二氧化碳的混合气体100g中,经测定含有二氧化碳44g,则该混合气体中,碳、氧两种元素的质量比为_____________。
(拓展)小明将点燃的火柴竖直向上放置(火焰在上方,火柴梗在下方),火焰很快就熄灭了,这是因为_____________。
【题目】科学探究和证据推理是化学学科的核心素养。化学兴趣小组对“测定空气中氧气的含量”实验进行探究,并基于证据进行推理分析。
I.用红磷测定空气中氧气的含量
(1)写出红磷在空气中燃烧的化学方程式:___________。
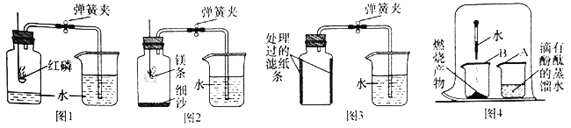
(2)某同学利用图1所示装置进行实验,步骤如下:
①用弹簧夹夹紧胶皮管;
②点燃燃烧匙内的红磷,立即伸入瓶中并塞紧瓶塞;
③___________;
④观察并记录水面的变化情况。
多次实验发现,集气瓶内水平面上升始终小于1/5。
Ⅱ.用镁条测定空气中氧气的含量
(3)某同学进行图2所示实验时发现,产物中有少许黄色固体。
(提出问题)黄色固体是什么呢?
(查阅资料)①氧化镁为白色固体;
②镁能与空气中的___________反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水反应生成氨气。
(做出猜想)黄色固体为Mg3N2
(实验过程)进行图4所示实验:取燃烧产物于烧杯B中,加入适量水,然后用大烧杯罩住小烧杯A和B。
(实验结论)观察到的现象是___________,据此可推断燃烧产物中含氮化镁(Mg3N2)。
(反思交流)进行图2所示实验时,在确保规范操作的前提下,该同学所测得的空气中氧气的体积分数___________(填“大于”“小于”或“等于”)1/5。
Ⅲ.用铁粉测定空气中氧气的含量
(4)某同学利用铁生锈的原理,用铁粉测定空气中氧气的含量,实验装置如图3所示。当烧杯中不再有水进入集气瓶时,该同学停止实验。实验开始和结束时所采集的数据如下表:
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 烧杯内水 | 烧杯内剩余水 |
250mL | 180.0mL | 129.5mL |
①铁生锈的原理是铁与空气中的___________发生反应。
②实验时该同学不是将铁粉堆在瓶底,而是将铁粉撒在浸润了氯化钠溶液的滤纸条上,再将滤纸条贴在集气瓶内壁,其目的是___________。
③该同学所测得的空气中氧气的体积分数为___________(精确到0.1%)。
④与红磷燃烧法相比,用该法测定空气中氧气含量的主要优点是___________。
Ⅳ.拓展应用
(5)取2.4g镁条在足量O2和N2的混合气体中完全燃烧,所得固体质量为a g,则a的取值范围是3.3<a<___________。