题目内容
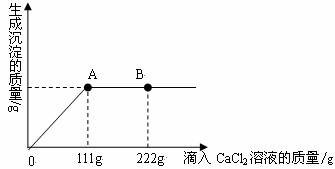
学校探究小组为了测定市面销售的某品牌纯碱(杂质为NaCl)中碳酸钠的质量分数,在一烧杯中加入11g样品,加足量水溶解,制成溶液.向其中逐渐滴加溶质质量分数为10%的CaCl2溶液,生成沉淀的总质量与所滴入CaCl2溶液的质量关系曲线如图所示.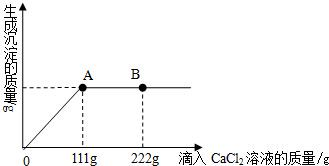
请根据题意回答问题:
(1)当滴加了111gCaCl2溶液时,生成沉淀的总质量为
(2)当滴加CaCl2溶液至图中B点时,烧杯中溶液里的溶质是(写化学式)
(3)样品中Na2CO3的质量分数是多少?(计算结果精确到0.1%).
当滴加了111gCaCl2溶液时(即A点时),烧杯中为不饱和溶液,试通过计算求出其中含溶质的质量.
分析:纯碱样品中氯化钠不与氯化钙发生反应,碳酸钠与氯化钙反应生成氯化钠和碳酸钙沉淀;
根据质量关系曲线图,当加入111g氯化钙溶液时,恰好完全反应;继续加入氯化钙溶液,氯化钙过量,溶液中溶质为过量的氯化钙和反应生成的氯化钠.
根据质量关系曲线图,当加入111g氯化钙溶液时,恰好完全反应;继续加入氯化钙溶液,氯化钙过量,溶液中溶质为过量的氯化钙和反应生成的氯化钠.
解答:解:(1)设生成碳酸钙沉淀的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl
111 100
111g×10% x
111:100=(111g×10%):x
x=10g
故答:10;
(2)碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,当二者恰好完全反应时,反应后溶液为氯化钠溶液;继续加入氯化钙溶液,过量的氯化钙溶液不再发生反应,形成混合溶液,溶质为氯化钠、氯化钙;
故答:氯化钠、氯化钙;
(3)解:111g10%的CaCl2溶液中含CaCl2的质量是:111g×10%=11.1g
设参加反应的碳酸钠的质量为x,反应生成的氯化钠的质量为y
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 111 117
x 11.1g y
106:111=x:11.1g 解之得 x=10.6g
Na2CO3的质量分数=
×100%=96.4%
117:111=y:11.1g
解之得 y=11.7g
烧杯里不饱和溶液中溶质的质量为:11.7g+(11g-10.6g)=12.1g
答:样品中Na2CO3的质量分数是96.4%;当滴加了111gCaCl2溶液时烧杯中为不饱和溶液,其中含溶质的质量11.7g.
Na2CO3+CaCl2=CaCO3↓+2NaCl
111 100
111g×10% x
111:100=(111g×10%):x
x=10g
故答:10;
(2)碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,当二者恰好完全反应时,反应后溶液为氯化钠溶液;继续加入氯化钙溶液,过量的氯化钙溶液不再发生反应,形成混合溶液,溶质为氯化钠、氯化钙;
故答:氯化钠、氯化钙;
(3)解:111g10%的CaCl2溶液中含CaCl2的质量是:111g×10%=11.1g
设参加反应的碳酸钠的质量为x,反应生成的氯化钠的质量为y
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 111 117
x 11.1g y
106:111=x:11.1g 解之得 x=10.6g
Na2CO3的质量分数=
| 106g |
| 11g |
117:111=y:11.1g
解之得 y=11.7g
烧杯里不饱和溶液中溶质的质量为:11.7g+(11g-10.6g)=12.1g
答:样品中Na2CO3的质量分数是96.4%;当滴加了111gCaCl2溶液时烧杯中为不饱和溶液,其中含溶质的质量11.7g.
点评:加入111g氯化钙溶液恰好完全反应,生成沉淀达最大值,再加入氯化钙溶液时,不再发生反应,所以沉淀的质量不再改变.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
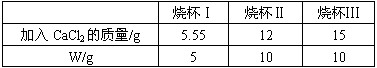
学校探究小组为了测定市面销售的某品牌纯碱(杂质为NaCl)中碳酸钠的质量分数,进行了如下实验:
①在三个烧杯中都加入1lg样品及足量的水配成溶液;
②向三个烧杯加入质量不同的CaCl2粉末;(化学方程式为Na2CO3+CaCl2═CaCO3↓+2NaCl)
③将充分反应后生成的沉淀过滤、洗涤、干燥得到w g的白色同体.实验数据如下:
回答下列问题:
(1)碳酸钠中钠、碳、氧三种元素的质量比(最简比)为 .
(2)将烧杯IlI的滤液蒸干,得到 g固体,该固体由 和 (只填化学式)组成.
(3)样品中碳酸钠的质量分数是多少?
①在三个烧杯中都加入1lg样品及足量的水配成溶液;
②向三个烧杯加入质量不同的CaCl2粉末;(化学方程式为Na2CO3+CaCl2═CaCO3↓+2NaCl)
③将充分反应后生成的沉淀过滤、洗涤、干燥得到w g的白色同体.实验数据如下:
| 烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ | |
| 加入CaCl2的质量/g | 5.55 | 12 | 15 |
| W/g | 5 | 10 | 10 |
(1)碳酸钠中钠、碳、氧三种元素的质量比(最简比)为
(2)将烧杯IlI的滤液蒸干,得到
(3)样品中碳酸钠的质量分数是多少?
学校探究小组为了测定市面销售的某品牌纯碱(杂质为NaCl)中碳酸钠的质量分数,进行了如下实验:
①在三个烧杯中都加入1lg样品及足量的水配成溶液;
②向三个烧杯加入质量不同的CaCl2粉末;(化学方程式为Na2CO3+CaCl2═CaCO3↓+2NaCl)
③将充分反应后生成的沉淀过滤、洗涤、干燥得到w g的白色同体.实验数据如下:
回答下列问题:
(1)碳酸钠中钠、碳、氧三种元素的质量比(最简比)为______.
(2)将烧杯IlI的滤液蒸干,得到______g固体,该固体由______和______(只填化学式)组成.
(3)样品中碳酸钠的质量分数是多少?
①在三个烧杯中都加入1lg样品及足量的水配成溶液;
②向三个烧杯加入质量不同的CaCl2粉末;(化学方程式为Na2CO3+CaCl2═CaCO3↓+2NaCl)
③将充分反应后生成的沉淀过滤、洗涤、干燥得到w g的白色同体.实验数据如下:
| 烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ | |
| 加入CaCl2的质量/g | 5.55 | 12 | 15 |
| W/g | 5 | 10 | 10 |
(1)碳酸钠中钠、碳、氧三种元素的质量比(最简比)为______.
(2)将烧杯IlI的滤液蒸干,得到______g固体,该固体由______和______(只填化学式)组成.
(3)样品中碳酸钠的质量分数是多少?