题目内容
【题目】粗盐中除了含有NaCl外,还含有MgCl2、CaCl2、Na2SO4等可溶性杂质。同学们为了得到更纯的NaCl,设计了如下实验方案:
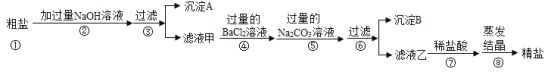
请回答下列问题:
(1)沉淀A的化学式是______;
(2)若将步骤④和⑤顺序颠倒会引发的后果是______;
(3)沉淀B中除了含有CaCO3以外还含有______(填化学式);
(4)滤液乙中含有的阴离子是______(填离子符号)。
【答案】Mg(OH)2 精盐中会混有氯化钡 BaSO4 、BaCO3 Cl-、OH-、CO32-
【解析】
(1)盐与碱之间的反应是复分解反应,生成物中必须有沉淀,加入过量NaOH 溶液,NaOH 溶液只能与粗盐中的MgCl2反应,MgCl2 +2NaOH==Mg(OH)2↓+2NaCl,所以沉淀A的化学式是Mg(OH)2。
(2)加入氯化钡,除去SO42-,反应的化学方程式为:Na2SO4+BaCl2==BaSO4↓+2NaCl,加入碳酸钠除去Ca2+和前面过量的Ba2+,反应的化学方程式为:Na2CO3+CaCl2==CaCO3↓+2NaCl、BaCl2 +Na2CO3 ==BaCO3↓+2NaCl。加入的碳酸钠溶液应该放在氯化钡溶液之后,否则多余的钡离子无法除去,精盐中会混有氯化钡;
(3)根据除杂过程可知,沉淀B中含有CaCO3、BaSO4、BaCO3,故填:BaSO4、BaCO3;
(4)根据除杂过程可知,滤液乙中含有的溶质是NaCl、Na2CO3、NaOH,所以含有的阴离子是Cl-、OH-、CO32-。

【题目】根据以下实验内容,回答相关问题。
[实验目的]证明氢氧化钠溶液与稀盐酸发生了反应且生成了新物质;
[实验原理]____________(用化学方程式表示);
[药品仪器]
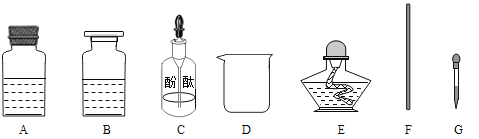
[实验步骤]
①取_______(选填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;
②用_______(填图中仪器对应字母)向①中溶液滴加稀盐酸,直至红色消失;
③向②中溶液继续滴加过量稀盐酸,溶液保持无色:
④用F蘸取③中溶液,在酒精灯上灼烧,有白色固体产生。
[思考拓展](1)步骤③的目的是____________;
(2)如不使用酸碱指示剂,进一步确认步骤④中的白色固体不是氢氧化钠的方法是_____________;
(3)已知酚酞试液在不同pH时的变色情况如下表。
pH | <8.2 | 8.2~10.0 | >10.0 |
颜色 | 无色 | 红色 | 无色 |
某同学发现:向某氢氧化钠溶液中滴加酚酞试液后溶液显无色;逐滴加稀盐酸,溶液先变红,后褪至无色。你认为该氢氧化钠溶液滴加酚酞试液显无色的原因可能是_________;请设计实验证明你的精想(写出简要的操作步骤与现象)_________________。