题目内容
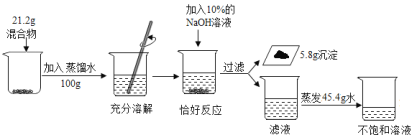
【题目】为测定氯化钠和氯化镁混合物的组成情况,张南同学进行了如下实验。请回答下列问题:
(1)实验中发生反应的化学方程式为_____;
(2)求解混合物中氯化镁的质量(x)的比例式为_____;
(3)混合物中钠元素和镁元素质量的最简整数比为_____;
(4)所得不饱和溶液中溶质的质量分数为_____;配制实验中的氢氧化钠溶液需要的实验用品有烧杯、玻璃棒、氢氧化钠固体、药匙、托盘天平、量筒,其中还缺少的实验用品有_____(填名称)。
【答案】MgCl2+2NaOH═Mg(OH)2↓+2NaCl ![]() 或
或![]() 23:12 15.6% 胶头滴管、蒸馏水
23:12 15.6% 胶头滴管、蒸馏水
【解析】
氯化镁能和氢氧化钠反应生成白色沉淀氢氧化镁和氯化钠,根据提供的数据和反应的化学方程式可以进行相关计算和判断。
解:(1)实验中氯化镁和氢氧化钠反应生成氢氧化镁沉淀和氯化钠,发生反应的化学方程式为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl;
(2)设氯化镁质量为x,反应的氢氧化钠质量为y,生成氯化钠质量为z,
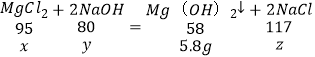
![]() x=9.5g,
x=9.5g,
![]() y=8g,
y=8g,
![]() z=11.7g,
z=11.7g,
(3)混合物中氯化钠的质量为:21.2g﹣9.5g=11.7g,故混合物中钠元素和镁元素质量的最简整数比为(11.7g×![]() ):(9.5g×
):(9.5g×![]() )=23:12;
)=23:12;
(4)不饱和溶液质量为:21.2g+100g+(8g÷10%)﹣5.8g﹣45.4g=150g,所得不饱和溶液中溶质的质量分数为:![]() ×100%=15.6%;配制实验中的氢氧化钠溶液需要的实验用品有烧杯、玻璃棒、氢氧化钠固体、药匙、托盘天平、量筒,其中还缺少的实验用品有胶头滴管、蒸馏水。
×100%=15.6%;配制实验中的氢氧化钠溶液需要的实验用品有烧杯、玻璃棒、氢氧化钠固体、药匙、托盘天平、量筒,其中还缺少的实验用品有胶头滴管、蒸馏水。

练习册系列答案
相关题目