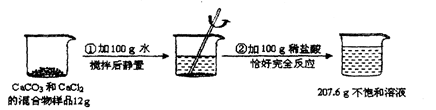题目内容
湿法冶金是我国古代劳动人民智慧的结晶.若向ag含杂质的铁粉中(假设杂质不溶于水,也不与其他物质反应)加入l60g溶质的质量分数为l0%的硫酸铜溶液,恰好完全反应后,过滤得到6.8g干燥固体,同时得到一种不饱和溶液(滤液损失忽略不计).
请回答下列问题:
(1)写出上述反应的化学方程式 ;
(2)根据硫酸铜质量列出求解样品中铁的质量(x)的比例式 ;
(3)a的数值为 ;
(4)若向反应后的滤液中加入40.8g水,则所得溶液中溶质的质量分数为 ;
(5)工业上若要得到120t上述铁粉,需要含杂质(杂质不含铁元素)20%的赤铁矿的质量是 .
(1)Fe+CuS04=Cu+FeSO4;(2)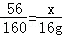 ;(3)6;(4)7.6%;(5)200t.
;(3)6;(4)7.6%;(5)200t.
解析试题分析:(1)湿法冶金的原理是:铁与硫酸铜反应生成了硫酸亚铁和铜,反应的方程式是:Fe+CuS04=Cu+FeSO4;
(2)硫酸铜的质量为l60g×l0%=16g
设生成的铜的质量为y、硫酸亚铁的质量为z
Fe+CuS04=FeSO4+Cu;
56 160 152 64
x l6g z y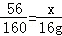 解得x=5.6g
解得x=5.6g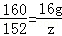 解得:z=15.2g
解得:z=15.2g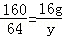 解得:y=6.4g
解得:y=6.4g
(3)由题可知:a=5.6g+(6.8g﹣6.4g)=6g
(4)所得溶液中溶质的质量分数为: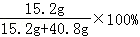 =7.6%
=7.6%
(5)铁的质量为:120t×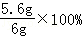 =112t
=112t
设需要赤铁矿石的质量为m.
Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
160 112
m(1﹣20%) 112t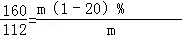 解得:m=200t
解得:m=200t
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.
点评:本题的综合性较强,比较全面地考查了化学方程式的书写、化学方程式的计算、溶液质量分数的计算,含杂质的化学方程式的计算等,只有全面地掌握了有关的化学计算才能较好地完成本题.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案如图是一瓶医用注射盐水标签的部分内容.用计算结果填空:
| 主要成分: NaCl、H2O 体积:500mL 含量:0.9% 密度:1g/cm3 |
(1)氯化钠中钠、氯元素的质量比是 ;
(2)氯化钠中钠元素的质量分数是 (精确到0.1%);
(3)该瓶盐水能给病人提供氯化钠的质量是 g.