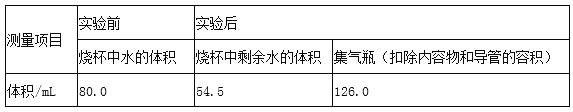
题目内容
【题目】单质B是一种常见且用途广泛的金属,B元素在地壳中含量仅次于铝,已知金属B能发生如下一系列变化:试推断:
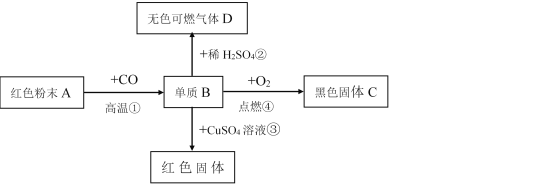
(1)写出A——E的名称:A.___ B._____ C.______ D.______ E._____。
(2)写出1、3各步反应的化学方程式:
①__________________
③__________________
【答案】氧化铁 铁 四氧化三铁 氢气 铜 Fe2O3+3CO![]() 2Fe+3CO2 Fe+CuSO4=Cu+FeSO4
2Fe+3CO2 Fe+CuSO4=Cu+FeSO4
【解析】
由于单质B是一种常见且用途广泛的金属,B元素在地壳中含量仅次于铝,可知B是铁,A是红色含铁的氧化物,所以A是氧化铁,由铁与硫酸反应可生成可燃性气体氢气可知,D是氢气,铁在氧气中燃烧会生成四氧化三铁的黑色固体C,铁与硫酸铜会发生置换反应生成红色的金属铜。
由分析可知:(1)A、氧化铁;B、铁;C、四氧化三铁;D、氢气;E、铜;
(2)①是一氧化碳与氧化铁高温下生成铁和二氧化碳,反应的化学方程式:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
③是铁和硫酸铜反应生成铜和硫酸亚铁,反应的化学方程式:Fe+CuSO4=Cu+FeSO4。

【题目】为了检测石灰石样品中碳酸钙的含量,甲、乙、丙、丁四位同学分别用质量分数相同的盐酸与样品充分反应进行实验测定。已知,样品中的杂质不溶于水,且不与盐酸反应。测得数据如下表:
甲 | 乙 | 丙 | 丁 | |
所取石灰石样品质量/g | 10.0 | 10.0 | 10.0 | 10.0 |
加入盐酸的质量/g | 20.0 | 30.0 | 45.0 | 50.0 |
剩余固体的质量/g | 6.0 | 4.0 | 2.0 | 2.0 |
请回答:
⑴ 样品中碳酸钙的质量分数是_______;
⑵10.0 g样品与45.0 g盐酸充分反应后,盐酸是否还有剩余_______(填“是”或“否”);
⑶10.0 g样品与足量稀盐酸反应后可产生二氧化碳_____克?(写出计算过程,计算结果精确到0.1 g)
(可能用到的相对原子质量:H—1 C—12 O—16 Cl—35.5 Ca—40)