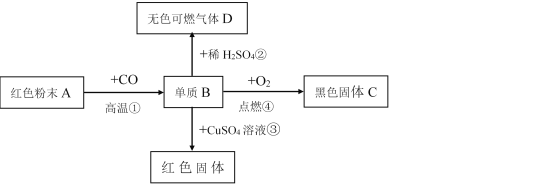
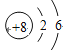题目内容
【题目】某样品有氧化铜和铜组成。取样品12g于烧杯中,向其中加入192g某浓度的稀硫酸,恰好完全反应,最终所得到的溶液质量为200g。
(1)氧化铜(CuO)中,铜、氧元素的质量比为_______;
(2)所取样品中氧化铜质量为_________ g;
(3)计算所用稀硫酸的溶质质量分数________。(要求写出计算过程)
【答案】4:1 8 5.1%
【解析】
(1)根据化学式的意义计算出氧化铜中铜、氧元素的质量比;
(2)铜不能和稀硫酸反应,氧化铜和稀硫酸反应生成硫酸铜和水,溶液增加的质量即为参加反应的氧化铜的质量;
(3)根据氧化铜的质量可以计算稀硫酸中溶质的质量,进一步可以计算稀硫酸的溶质质量分数。
解:(1)氧化铜中,铜、氧元素的质量比为64:16=4:1;
(2)铜不能和稀硫酸反应,氧化铜和稀硫酸反应生成硫酸铜和水,溶液增加的质量即为参加反应的氧化铜的质量为:200g-192g=8g;
(3)设所用稀硫酸的溶质质量为x,
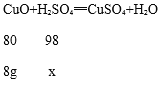
![]()
x=9.8g
所用稀硫酸的溶质质量分数为:![]() ×100%≈5.1%
×100%≈5.1%
答:(1)氧化铜中,铜、氧元素的质量比为4:1;(2)所取样品中氧化铜质量为8g;(3)所用稀硫酸的溶质质量分数为5.1%。

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】某同学取回矿石样品,他对样品中的碳酸钙的质量分数进行检测,方法是:取矿石样品8g,将40g盐酸溶液分四次加入,所得数据如下表(已知石灰石样品中的杂质不溶于水,不与盐酸反应)请计算:
序号 | 加入稀盐酸的质量(g) | 剩余固体的质量(g) |
1 | 10 | 5.5 |
2 | 10 | 3 |
3 | 10 | 1.2 |
4 | 10 | 1.2 |
(1)样品中碳酸钙的质量分数___________________;
(2)求共产生多少克的二氧化碳_____________?
【题目】生铁是铁和碳等元素形成的合金![]() 为测定某生铁样品中铁的质量分数所进行的某次实验中,称取粉碎后的该生铁样品
为测定某生铁样品中铁的质量分数所进行的某次实验中,称取粉碎后的该生铁样品![]() ,放入烧杯中,向其中加入
,放入烧杯中,向其中加入![]() 的稀硫酸,充分搅拌使其恰好完全反应
的稀硫酸,充分搅拌使其恰好完全反应![]() 碳等杂质既不溶于水也不与酸反应
碳等杂质既不溶于水也不与酸反应![]() 测得的实验数据如下:
测得的实验数据如下:
反应前 | 反应后 | |
烧杯及其中物质的总质量 |
|
|
根据实验数据进行计算![]() 结果保留一位小数
结果保留一位小数![]() :
:
![]() 产生氢气的质量为______g;
产生氢气的质量为______g;
![]() 该生铁样品中铁的质量分数_______;
该生铁样品中铁的质量分数_______;
![]() 反应后所得溶液的溶质质量分数_______.
反应后所得溶液的溶质质量分数_______.