题目内容
【题目】硫酸钙转化学 K2SO4和 CaCl2.6H2O 的工艺流程如下:
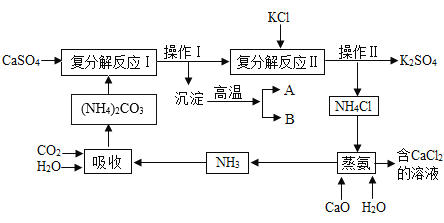

(1)吸收过程中发生了化合反应,化学方程式为____。
(2)操作Ⅰ的名称为_,沉淀的主要物质为____(填化学式)。
(3)复分解反应Ⅱ的化学反应方程为:_______。操作Ⅱ包含的操作是__。
(4)蒸氨过程中涉及的化应类型为_____(填编号)
A 复分解反应
B 化合反应
C 分解反应
D 置换反应
(5)操作Ⅲ包含一系列操作:蒸发浓缩、_____、过滤、洗涤、干燥。
(6)可循环利用的物质除了 NH3外,还有____(填化学式)。
【答案】![]() 过滤 CaCO3
过滤 CaCO3 ![]() 蒸发浓缩、趁热过滤、冷却结晶、过滤、洗涤、干燥 AB 冷却结晶 CO2和CaO
蒸发浓缩、趁热过滤、冷却结晶、过滤、洗涤、干燥 AB 冷却结晶 CO2和CaO
【解析】
(1)根据流程图可知在吸收过程中,氨气、水和二氧化碳发生了化合反应生成了碳酸铵,反应的方程式是![]() 。
。
(2)碳酸铵与硫酸钙反应生成了碳酸钙沉淀和硫酸铵,是固液混合物,利用过滤的方法将它们分开,所以操作I的名称为过滤,沉淀的主要物质为CaCO3。
(3)复分解反应II利用的是NH4Cl和硫酸钾的溶解度受温度影响不同的特点,实现二者的分离,故反应的化学方程式为![]() ,操作Ⅱ包含的操作有:蒸发浓缩、趁热过滤、冷却结晶、过滤、洗涤、干燥等。
,操作Ⅱ包含的操作有:蒸发浓缩、趁热过滤、冷却结晶、过滤、洗涤、干燥等。
(4)在蒸氨过程中,氧化钙与水化合生成了生成了氢氧化钙,反应方程式为![]() ,该反应由两物质生成了一种物质,属于化合反应;氢氧化钙与氯化铵反应生成了氯化钙、氨气和水,反应的方程式为
,该反应由两物质生成了一种物质,属于化合反应;氢氧化钙与氯化铵反应生成了氯化钙、氨气和水,反应的方程式为![]() ,该反应有两种化合物相互交换成分生成了两种新的化合物,属于复分解反应,综上所述AB正确,符合题意。故选AB。
,该反应有两种化合物相互交换成分生成了两种新的化合物,属于复分解反应,综上所述AB正确,符合题意。故选AB。
(5)操作Ⅲ从氯化钙溶液中结晶析出![]() ,需要进行的操作包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
,需要进行的操作包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(6)由工艺流程图可知,可循环利用的物质除了NH3外,还有CO2和CaO。

 阅读快车系列答案
阅读快车系列答案【题目】元素周期表中,同周期元素的结构和性质呈现一定的规律性变化。下表列出的是第三周期元素的原子半径及主要化合价(部分信息未列出)。下列有关说法不正确的是( )
元素 | Na | Mg | ① | Si | P | ② | Cl |
原子的最外层电子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
原子半径(10-10m) | 1.86 | 1.60 | 1.43 | ③ | 1.10 | 10.2 | 0.994 |
最高正价最低负价 | +1 | +2 | ④ | +4 -4 | +5 -3 | ⑤ | +7-1 |
A.⑤处的最高正价是+6,最低负价是-2
B.元素①的原子序数是 13,①和②形成的化合物的化学式为 AlS
C.第三周期元素(Na→Cl)的最高正价数等于其原子的最外层电子数
D.③处的数值介于 1.10~1.43 之间
【题目】用“盐酸—硫酸钡法”生产BaCl2会放出有毒气体H2S(其水溶液有酸性),可用NaOH吸收H2S制取Na2S进行处理。(相关反应的化学方程式:H2S+2NaOH=Na2S+2H2O)
项目 | 单价(元/吨) |
NaOH | 2500 |
Na2S | 5000 |
辅助费用(以处理1吨H2S计) | 1114 |
(1)若某化工厂每天要处理10吨H2S,需消耗NaOH多少吨_____?
(2)下表为H2S回收工艺的各项生产成本:
根据上述资料分析,从经济效益考虑这种处理H2S的方法是___(选填“盈利”或“亏损”)的。
【题目】碳酸氢铵(NH4HCO3),俗称“碳铵”,是农村常用的氮肥。NH4HCO3可溶于水:受热容易分解,生成三种物质,经检测,这三种物质性质如下:
生成物 | 相关性质 |
生成物(一) | 无色无味的液体,常用作溶剂 |
生成物(二) | 能使澄清石灰水变浑浊的气体。 |
生成物(三) | 有刺激性气味的气体,水溶液呈碱性。 |
(1)请写出碳酸氢铵受热分解的化学方程式:_____。
(2)请预测碳酸氢铵的化学性质,说明预测的依据,并设计实验验证。
限选试剂是:碳酸氢铵粉末、熟石灰、食盐、稀硫酸、紫色石蕊溶液、炭粉、镁条、氧化铜。
预测 | 预测的依据 | 验证预测的实验操作与预期现象 |
①能够与酸类反应 | 碳酸氢铵组成里有碳酸氢根离子 | 取少量碳酸氢铵粉末于试管中,加入足量的_____,如果观察到_____,则预测成立。 |
②能够与_____(填物质类别)反应 | _____ | 取少量碳酸氢铵粉末_____。如果_____,则预测成立。 |