题目内容
(6分)①~⑥为初中化学常见物质的相互转化关系(反应条件已略去)。其中只有D、E、M为单质,且D为最轻的气体。H和L的组成元素相同。
① A+B→C ② A→D+E ③ F→A+E ④ G+K→H+A
⑤ G+M→L+D ⑥ Q+K→M+B
(1)则D为__________________。
(2)写出物质的化学式:C 、F 。
(3)写出反应的化学方程式:③ ;④ ;⑥ 。
(1)H2 (2)H2CO3 H2O2
(3)2H2O2 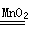 2H2O +O2↑ Fe2O3 + 3H2SO4 = Fe2(SO4)3 +3H2O (或与盐酸反应)
2H2O +O2↑ Fe2O3 + 3H2SO4 = Fe2(SO4)3 +3H2O (或与盐酸反应)
3CO + Fe2O3高温 2Fe +3 CO2
解析试题分析:解答推断题,要找出解题的突破口,或者说是“题眼”,常见的“题眼”有:特殊的物质颜色,特殊的反应条件及反应现象,甚至特殊的反应类型等,此题的“题眼”是且D为最轻的气体,可以判断D为氢气,再通过特殊的反应② A→D+E,可以判断A为水,E自然为氧气,所以发生反应③ F→A+E,F为过氧化氢,在根据反应⑤ G+M→L+D,要产生氢气,是通过金属与酸反应,而M为单质,所以最常见的为铁,G为酸(常见为盐酸或硫酸),反应生成氯化亚铁或硫酸亚铁,而H和L的组成元素相同,所以根据④ G+K→H+A,可以判断是氧化铁与盐酸或稀硫酸反应生成氯化亚铁或硫酸亚铁,由于反应⑥ Q+K→M+B生成M铁,所以K为氧化铁,G自然为盐酸或稀硫酸,再结合反应① A+B→C,B能与水反应,所以可判断A为二氧化碳,自然Q为一氧化碳
(1)则D为H2
(2)C物质的化学式为H2CO3,F物质的化学式为:H2O2
(3)反应③的化学方程式为:2H2O2 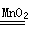 2H2O +O2↑,反应④的化学方程式为:Fe2O3 + 3H2SO4 = Fe2(SO4)3 +3H2O,反应⑥的化学方程式为:3CO + Fe2O3高温2Fe +3 CO2
2H2O +O2↑,反应④的化学方程式为:Fe2O3 + 3H2SO4 = Fe2(SO4)3 +3H2O,反应⑥的化学方程式为:3CO + Fe2O3高温2Fe +3 CO2
考点:推断题的解答

 阅读快车系列答案
阅读快车系列答案甲、X、Y、Z是初中化学中的常见物质,请根据下列叙述回答问题。
(1)若甲是生命活动中最重要的气体单质,则甲是 。
(2)若甲既可以作气体燃料,又可以用作还原剂冶炼金属铁。则甲的化学式是 ;用其还原氧化铁的化学反应方程式是 。
(3)若甲可以由Y与水在常温下反应制得,且可用来改良酸性土壤,则下列叙述正确的是 (填字母序号)。
| A.Y与水的反应属于化合反应 |
| B.甲易吸收空气中的水分而变质,所以需密封保存 |
| C.向滴有酚酞试液的甲的溶液中加入一定量的稀盐酸,溶液最终为无色,则所得溶液中的溶质只有CaCl2 |
| D.将少量Y加到甲的饱和溶液中,溶液变浑浊,反应后溶液中溶质和溶剂的质量一定减小,溶质的质量分数可能不变 |
(7分)已知某合金样品中可能含有铝、铁、铜中的两种或三种。某小组同学对该合金样品的成分进行探究。
【查阅资料】铝与氢氧化钠溶液可以发生反应,而铁、铜不与氢氧化钠溶液反应。
已知2Al + 2NaOH + 2X= 2NaAlO2 + H2↑,则X的化学式是 。
【探究实验】
| 实验方案 | 实验现象 | 结论 |
| 取一定量的合金样品,加过量的 ,充分反应后过滤,滤渣备用。 取步骤①所得滤渣,加 。 | 样品部分溶解,并有气体放出。 | 合金中一定含有 。 合金中一定含有铁和铜。 |
将Al、Cu分别加入到FeSO4溶液中
将Al、Fe分别加入到CuSO4溶液中
将Al分别加入到FeSO4、CuSO4溶液中
将Fe分别加入到Al2(SO4)3、CuSO4溶液中
下列实验方案中能达到实验目的是
| 选项 | 实验目的 | 实验方案 |
| A | 检验二氧化碳气体 | 插入燃着的木条,会熄灭的就是CO2 |
| B | 除去氢氧化钠中的少量碳酸钠 | 加入适量稀盐酸,充分反应后,蒸发 |
| C | 除去二氧化碳中少量一氧化碳 | 通过过量灼热的氧化铜 |
| D | 验证钠 铁 铜三种金属活动性 | 分别与水和盐酸反应 |


