题目内容
【题目】酸和碱的中和反应是中学化学中重要的学习内容,在日常生活和工农业生产中有广泛的应用。下图表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH的变化曲线。请从曲线图中获取信息,回答下列问题:
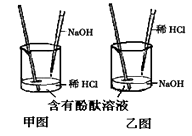
(1)实验操作是按照以上(填甲或乙)图所示进行,实验前烧杯中溶液的pH值7(填 >、< 或 =)。
(2)图中C点表示 , 图中B点所示溶液中,含有的离子有。
【答案】
(1)乙;>
(2)NaOH溶液与HCl溶液恰好完全反应,溶液呈中性;Na+、Cl-、H+
【解析】(1)由图可知溶液开始时显碱性,pH>7,随着反应的进行,溶液pH<7,溶液显酸性。由此可知实验操作是按照以上乙图所示进行,实验前烧杯中溶液的pH值>7;
(2)由图可知C点时溶液pH=7。表示NaOH溶液与HCl溶液恰好完全反应,溶液呈中性。图中B点所示溶液显酸性。溶液中含有的溶质为反应生成的NaCl和过量的HCl。故图中B点所示溶液中,含有的离子有Na+、Cl-、H+.
故答案为:(1)乙;>;(2)NaOH溶液与HCl溶液恰好完全反应,溶液呈中性;Na+、Cl-、H+.氢氧化钠溶液呈碱性,其pH大于7,盐酸呈酸性,其pH小于7,氢氧化钠溶液和盐酸可以发生中和反应生成氯化钠和水,恰好完全反应时其pH=7,氢氧化钠过量时显碱性,盐酸过量时显酸性.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目