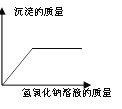
题目内容
【题目】下列图像不能正确反映其对应操作的是
A | B | C | D |
|
|
|
|
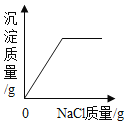
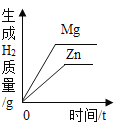
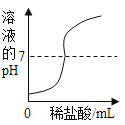
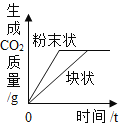
在一定量的AgNO3溶液中逐滴加入NaCl溶液 | 等质量Zn和Mg分别与足量的等浓度稀硫酸反应 | 向NaOH溶液中逐滴加入稀盐酸 | 等质量CaCO3分别与足量的等浓度稀盐酸反应 |
A. A B. B C. C D. D
【答案】C
【解析】A、在一定量的AgNO3溶液中逐滴加入NaCl溶液,不断产生白色沉淀。当恰好完全反应时沉淀达到最大值,正确;B、等质量的Zn和Mg分别与足量等体积等质量分数的稀硫酸反应,镁的活动性比锌强,反应速度比锌快,镁的相对原子质量比锌小,产生氢气比锌多,正确;C、向NaOH溶液中逐滴加入稀盐酸,氢氧化钠的pH大于7,起始点应大于7,随着盐酸的不断加入,pH逐渐减小,错误;D、由于反应物的质量相等,所以生成的二氧化碳的质量也相等,但由于碳酸钙的状态不一样,根据影响反应快慢的条件知粉末状的和盐酸接触面积大,反应快,所以粉末状的碳酸钙的图像应该陡一些,正确。故选C。

【题目】某实验小组取用生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂,于是小组中的几位同学对其中的成分进行了探究。

(提出猜想)小丹认为含有:CaO、Ca(OH)2;
小凯认为含有:CaO、Ca(OH)2、CaCO3;
小欣认为含有:Ca(OH)2、CaCO3。
(设计实验)
实验操作 | 实验现象 | 结论 | |
步骤一 | 取试样于试管中加水振荡 | 液体浑浊,用手摸试管外壁,感觉不发热 | ______________________ |
步骤二 | 向步骤一的试管中滴加无色酚酞溶液 | 溶液变红色 | ______________________ |
步骤三 | _______________________ | 试管内有气泡生成 | 一定含有CaCO3 |
(得出结论)通过以上探究可知_________同学的猜想正确,请写出使CaO变质的化学方程式:______。
(拓展)如果生石灰已全部变质为碳酸钙,请你设计实验加以证明(写出必要的步骤、现象和结论)___。
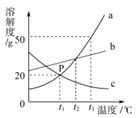
【题目】实验室需配置一定浓度的硝酸钾溶液。
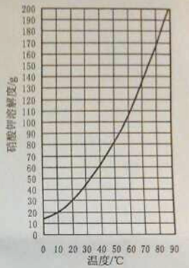
(1) 查阅硝酸钾溶解性。由右图可知,20℃时,硝酸钾的溶解度为 g,在该温度下配制硝酸钾溶液,溶质质量分数最大为 %(计算结果保留整数)。
(2)计算。配置40g质量分数为10%的硝酸钾溶液,所需硝酸钾质量为 g,所需蒸馏水的体积为 mL(水的密度近似看做1g/mL)。
(3)称量。分别在天平左右两盘放上纸片,调节平衡后, (填字母)。
A、先移动游码到所需位置,再添加硝酸钾直到天平平衡
B、先添加所需的硝酸钾,再移动游码直到天平平衡
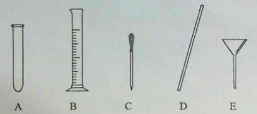
(4)量取。量取所需蒸馏水要用到的仪器是 (填字母)。
(5)溶解。将称量好的硝酸钾和蒸馏水混合溶解。
(6)稀释。20℃时,将20mL质量分数为10%的硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液。从下表中找出需要用到的数据: g/mL。
硝酸钾溶液的密度(单位1g/mL)
质量分数/% | 20 | 40 | 60 |
4 | 1.023 | 1.016 | 1.007 |
10 | 1.063 | 1.054 | 1.044 |
【题目】氢氧化钠、碳酸钠分别在水、酒精中的溶解度如表所示,请结合图表数据回答下列问题:
氢氧化钠 | 碳酸钠 | |||
20℃ | 40℃ | 20℃ | 40℃ | |
水 | 109g | 129g | 21.8g | 49g |
酒精 | 17.3g | 40g | 不溶 | 不溶 |
(1)下图表示________(填“氢氧化钠”或“碳酸钠”)的溶解度曲线。
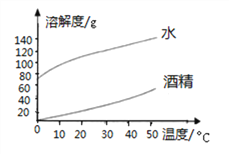
(2)温度从20℃升到40℃时,氢氧化钠在水中的溶解度变化__________(填“大于”或“小于”)碳酸钠在水中的溶解度变化。
(3)40℃ 时,若将50gNaOH分别投入到100g水和100g酒精中,能形成饱和溶液的溶剂是__,再将CO2通入所得NaOH的酒精溶液中,观察到的现象为______________。
(4)若要对比两种固体物质的溶解性,必须在_____________、______________ 、_____________的条件下进行对比。
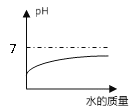
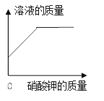
【题目】下列四个图像中,不能正确表示对应变化关系的是 ( )
|
|
|
|
A.向一定量稀硫酸中加水稀释 | B.一定温度下,向不饱和硝酸钾溶液中加入硝酸钾 | C.加热一定质量的 高锰酸钾固体 | D.向一定质量的硫酸铜和稀硫酸的混合溶液中逐滴加入氢氧化钠溶液 |
A. A B. B C. C D. D