题目内容
【题目】利用创新的实验装置进行实验(装置气密性良好)。
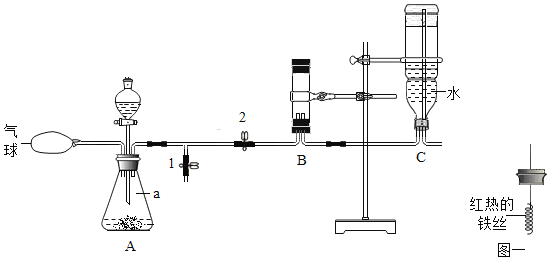
实验一:制取氧气并验证其性质
①写出编号a仪器的名称_____。
②利用A装置制取氧气的化学方程式是_____。
③打开弹簧夹1、关闭弹簧夹2,在尖嘴处观察到带火星的小木条复燃,说明_____。
④关闭弹簧夹1、打开弹簧夹2,利用_____收集氧气。反应一段时间后,B装置中液面不再发生变化时,关闭弹簧夹2,将红热的铁丝(图一)放入B装置中,观察到的现象是_____。
实验二:制取二氧化碳并验证其性质
①用粉末状大理石和稀盐酸为原料,利用A装置也可以制取CO2的原因是_____。
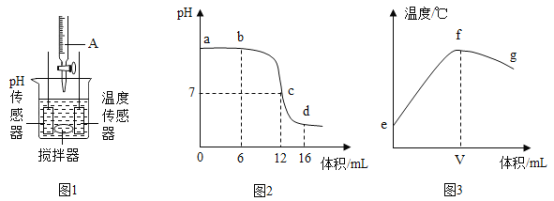
②打开弹簀夹1、关闭弹簧夹2,用3个250mL的烧瓶收集满CO2进行实验。
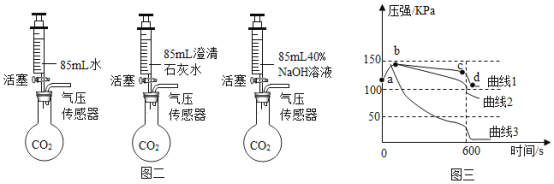
如图二所示,同时迅速将注射器内液体全部注入各自烧瓶中,关闭活塞;一段时间后,同时振荡三个烧瓶。得到如图三所示的烧瓶内压强与时间的关系曲线图。
I、曲线1中导致cd段气压快速变小的操作是_____。
II、曲线2中发生反应的化学方程式为_____。
Ⅲ、比较曲线2与曲线3的差异,说明原因_____。
IV、根据图三所示,可以得出的结论是_____(填序号)。
A 1体积水中溶解CO2的量小于1体积
B CO2能与水发生反应
C CO2能与NaOH溶液发生反应
D 检验CO2用饱和澄清石灰水较合适
V、实验室制取2.2g二氧化碳,至少需要碳酸钙多少mol?(请根据化学方程式列式计算)_____。
【答案】锥形瓶 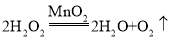 氧气具有助燃性 排水法 火星四射,有黑色固体生成 反应物为固液混合物,且不需要加热 振荡烧瓶
氧气具有助燃性 排水法 火星四射,有黑色固体生成 反应物为固液混合物,且不需要加热 振荡烧瓶 ![]() 氢氧化钠浓度大于氢氧化钙浓度,吸收二氧化碳多 C 0.05(详见解析)
氢氧化钠浓度大于氢氧化钙浓度,吸收二氧化碳多 C 0.05(详见解析)
【解析】
实验一:①、a为固液反应容器锥形瓶;
②、装置为固液不加热发生装置,所以选择过氧化氢和二氧化锰制取氧气,过氧化氢在二氧化锰催化作用下分解生成水和氧气,化学方程式为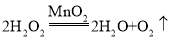 ;
;
③、木条在氧气存在时复燃,说明氧气具有助燃性;
④、B内充满了水,氧气不易溶于水,所以可以用排水法收集;铁与氧气在点燃条件下反应生成四氧化三铁,火星四射,四氧化三铁为黑色固体,观察到的现象是火星四射,有黑色固体生成;
实验二:①、实验室采用大理石与稀盐酸制取二氧化碳,反应物为固液混合物,不需要加热,据此选择发生装置;
②Ⅰ.cd段二氧化碳溶于水造成压强减小,通过振荡烧瓶,增加液体与气体接触,加快了溶解速率;
Ⅱ.氢氧化钙溶解度小,溶解的氢氧化钙较少,所以反应后压强减小的少,因此曲线2是二氧化碳溶解在澄清石灰水中的数据,二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,化学方程式为![]() ;
;
Ⅲ.氢氧化钠浓度高,吸收的二氧化碳多,气体减少的体积多,所以压强减小的多,曲线2与曲线3的差异原因是:氢氧化钠浓度大于氢氧化钙浓度,吸收二氧化碳多;
ⅣA、曲线1反应前后压强基本不变,说明加入水的体积溶解相等体积的气体,因此压强不变,相当于1体积水溶解1体积二氧化碳,A错误;
B、二氧化碳与水是否发生反应,无法证明,只能证明加入水的体积消耗了等体积的二氧化碳,是反应还是溶解,无法判断,B错误;
C、曲线1和曲线3压缩下降不同,说明二氧化碳与氢氧化钠发生了反应,C正确;
D、图三知识压强变化数据,没有涉及反应中实际现象,所以检验二氧化碳选用饱和澄清石灰水不是根据此图得出的,D错误。
故填:C。
V、设反应消耗碳酸钙质量为x,则
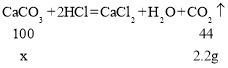
![]()
解得x=5g,所以碳酸钙物质的量为![]() 。
。
答:制取2.2g二氧化碳,至少需要碳酸钙多少0.05mol。

【题目】CaCO3广泛存在于自然界,是一种重要的化工原料。某种大理石除主要成分CaCO3外,还含有少量的硫化钙。小李和小明同学用这种大理石和盐酸反应,分别开展以下探究,请你参与探究并回答相关问题。
[查阅资料]
资料一:已知复分解反应![]() 可自发进行。在常温下,测得浓度为a%的下列五种溶液的pH大小情况如下表所示:
可自发进行。在常温下,测得浓度为a%的下列五种溶液的pH大小情况如下表所示:
溶质 | H2SO4 | HCl | H2S | H2CO3 | HClO |
pH | 小→大 | ||||
表中pH大小情况揭示出复分解反应的一条规律,即较强酸发生类似反应可以生成较弱酸。下列反应均能发生,其中不符合该规律的是_____________(填字母代号)。
A![]()
B![]()
C![]()
D![]()
资料二:常见的干燥剂有①浓硫酸、②无水氯化钙、③氢氧化钠固体、④生石灰、⑤五氧化二磷。
[实验探究]小茜同学为了得到纯净的二氧化碳,设计了如图所示装置,请你分析:
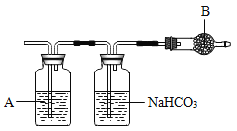
(1)制备的二氧化碳气体中,可能含有的杂质是____________。
(2)上述装置中,A是______________溶液,NaHCO3溶液可以吸收_____________。
(3)上述装置中,B物质不可能是_________(填字每代号)。
A五氧化二磷 B无水氯化钙 C氢氧化钠固体 D生石灰
(4)如果B失效,则得到的二氧化碳质量__________(“偏高”“偏低”或“不受影响”)。