题目内容
【题目】化学小组选用如图装置制取并收集氧气。
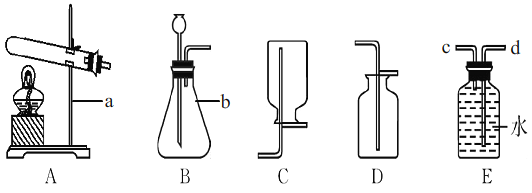
(1)仪器的名称:a:_______,b:______。
(2)若用高锰酸钾制取氧气,可选用的发生装置是__,需要改进的地方是 _________,该反应的文字表达式为 ___________。
(3)写出过氧化氢与二氧化锰制取氧气的收集装置是 D(或E) (填标号),利用了氧气的______________性质。
(4)用排空气法收集氧气证明已收集满的方法是_______
(5)若用E装置干燥氧气,气体应从_____(填“c”或“d”)端进入。
(拓展设问)
(6)用氯酸钾和二氧化锰制取氧气,反应发生的文字表达式为___________。反应前后二氧化锰的质量_______(填“增大”“减小”或“不变”)。
(7)用排水法收集氧气时,当________,开始收集氧气;实验完毕后,应先撤出导管,然后熄灭酒精灯,其原因是 __________。
【答案】铁架台锥形瓶A试管口塞一团棉花高锰酸钾![]() 锰酸钾+二氧化锰+氧气密度比空气大(不易溶于水也不与水发生反应)将带火星的木条放在集气瓶口,若木条复燃,则已集满d氯酸钾
锰酸钾+二氧化锰+氧气密度比空气大(不易溶于水也不与水发生反应)将带火星的木条放在集气瓶口,若木条复燃,则已集满d氯酸钾![]() 氯化钾+氧气不变气泡连续均匀冒出时防止水倒吸入试管,使试管骤冷而炸裂
氯化钾+氧气不变气泡连续均匀冒出时防止水倒吸入试管,使试管骤冷而炸裂
【解析】
(1)仪器的名称:a:铁架台,b:锥形瓶;
(2)高锰酸钾在加热条件下分解生成锰酸钾、氧气、二氧化锰,若用高锰酸钾制取氧气,可选用的发生装置是固-固加热型A,需要改进的地方是试管口塞一团棉花,防止高锰酸钾颗粒堵塞导管,反应的文字表达式为:高锰酸钾![]() 锰酸钾+二氧化锰+氧气;
锰酸钾+二氧化锰+氧气;
(3)氧气的密度比空气的大,可以用向上排空气法收集,收集装置是 D;氧气难溶于水,可以用排水法收集,收集装置是 E;
(4)氧气有助燃性,可使带火星的木条复燃,用排空气法收集氧气证明已收集满的方法是将带火星的木条放在集气瓶口,若木条复燃,则已集满;
(5)干燥或除杂时,气体都是长进短处,若用E装置干燥氧气,气体应从d端进入;
(6)氯酸钾在二氧化锰的作用下受热分解生成氯化钾和氧气,反应发生的文字表达式为氯酸钾 ![]() 氯化钾+氧气;能改变其他物质的反应速率而本身的质量和化学性质在反应前后不变的物质叫催化剂,二氧化锰是该反应的催化剂,反应前后二氧化锰的质量不变;
氯化钾+氧气;能改变其他物质的反应速率而本身的质量和化学性质在反应前后不变的物质叫催化剂,二氧化锰是该反应的催化剂,反应前后二氧化锰的质量不变;
(7)用排水法收集氧气时,当导管口气泡连续均匀冒出时,开始收集氧气;实验完毕后,应先撤出导管,然后熄灭酒精灯,其原因是防止水倒吸入试管,使试管骤冷而炸裂。

【题目】小婧同学学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体。但她在空气中点燃镁条时,却发现在生成的白色固体中还夹杂着少量的淡黄色固体。
[提出问题]为什么会生成淡黄色固体?
[查阅资料]小婧查阅资料,记录了下列几种物质的颜色:
物 质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
颜 色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
其他同学认为不必查阅氯化镁的颜色,理由是___________________________;
同时小婧还查阅到:镁可以在CO2中燃烧,生成氧化镁和一种黑色固体。你认为黑色固体是________
[提出猜想]分析资料,小婧认为淡黄色固体可能是由镁与空气中的______反应生成的;
[实验探究]小婧设计实验证实了自己的猜想,她的方案可能是________________;
[实验结论]根据小婧的实验结果,写出镁条在空气中燃烧时两个反应的化学方程式:_________ 、_____
[反思与评价]通过上述实验和有关资料,你对燃烧及灭火有什么新的认识?(写出2点)____________、_________________。
【题目】某小组对 H2O2 溶液制取氧气进行了如下探究:
(探究一)探究不同催化剂对 H2O2分解速率的影响该小组采用了如下图所示装置进行实验,实验中催化剂均为0.4g,H2O2溶液均为20mL,浓度均为 10%。在C框中连接导管和量筒,并测量收集到 50mL 水时的某项数据, 经计算后绘制出下表:
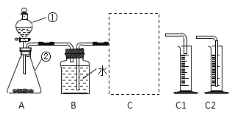
(1)检查 A 装置气密性的方法是:用弹簧夹夹住 A 装置右侧胶皮管,打开①上方的塞子, 向其中加水,打开①的活塞,若__________,则气密性良好。
(2)C 框内选用C1或C2装置,对该探究实验结论有无影响__________。
(3)从实验数据可知:相同条件下,表中催化剂的催化效果由强到弱依次为______。
催化剂种类 | 气体产生速率(mL/s) |
二氧化锰 | 3.5 |
氧化铜 | 4.5 |
活性炭 | 5.8 |
(4)该探究实验中,需要测定的数据是__________。
(5)当量筒中收集到 50mL 水时,H2O2分解产生的氧气体积______50mL(填“大于”、 “等于”、“小于”)。
(探究二)探究 MnO2 的用量对H2O2分解速率的影响下图甲所示装置中产生氧气的量可以用压强传感器测出(在等温条件下,产生氧气体积与装置内压强成正比。反应放热忽略不计)
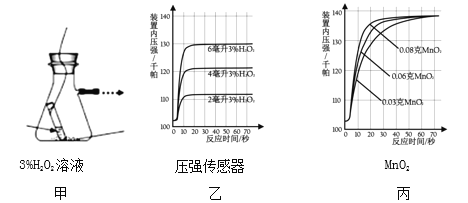
(1)图乙是“0.1gMnO2 与不同体积的 3%H2O2 溶液混合”的实验结果,从图中可以看出______________________。
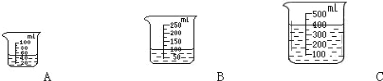
(2)当用“3%H2O2 溶液 8 毫升与不同质量的 MnO2 混合”时,得到如图丙所示的曲线。曲线的斜率显示,当 MnO2 的用量增加到 0.08g 时,H2O2 的分解速率达到实验要求。在此实验条件下,若MnO2的质量为4g(一药匙)时,能使下图____ (选填字母)烧杯中所装的3%H2O2溶液中 H2O2 的分解速率最接近实验要求。
(探究三)探究 H2O2 溶液的浓度对 H2O2 分解速率的影响如图所示,在250mL三颈瓶中均加入0.5gMnO2,在恒压漏斗中各加入20mL不同浓度的 H2O2 溶液,分别进行实验。用温度传感器测量并绘制出瓶内温度与时间的关系图。如下图 1 所示。再将该装置的三颈瓶浸入水浴池中(该池可使瓶内的溶液温度恒定在 20℃),用上述实验中相同量的各物质重复上述实验,用气压传感器测量并 绘制出瓶内气压与时间的关系图,如下图 2 所示。


不同浓度双氧水催化分解时温度与时间关系图,图 2-不同浓度双氧水催化分解时气压与时间关系图
(1)实验中,恒压漏斗的作用是__________。
(2)由图 1 知道:H2O2分解时会__________热量(填“放出”或“吸收”)。
(3)由图2知道:H2O2溶液浓度越高,H2O2 分解速率越______(填“快”或“慢”)。 以 10%H2O2 溶液为例,约 25S 后三颈瓶内气压由高缓慢降低的原因是_______。
(4)影响 H2O2 分解速率的因素,除了催化剂的种类、催化剂的用量、H2O2 溶液的浓度外,还可能有_______ 、_______等。