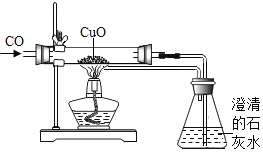
题目内容
【题目】为从废铜屑中得到较纯的单质铜设计了如下方案。有关说法正确的是 ( )
![]()
A.若X是铁,第③步反应还会生成氯化铁
B.X还可以是Zn,但不能是Ag
C.不需要第②步操作,直接进行第③步操作也能达到实验目的
D.向第②步反应后的溶液中加入硝酸银溶液,若产生白色沉淀即证明稀盐酸过量
【答案】B
【解析】
A、铁与盐溶液或酸发生置换反应后,生成亚铁盐,即铁与氯化铜反应后生成铜和氯化亚铁,选项错误;
B、活动性较强的金属可以和位于其后的金属的可溶性盐反应,锌的活动性位于铜的前面,而银的活动性位于铜的后面,所以上述废液中的X还可以是Zn,但不能是Ag,选项正确;
C、氧化铜不能与金属单质直接反应生成铜,必须将氧化铜转化为盐,再通过与活泼金属反应生成铜,选项错误;
D、向第②步反应后的溶液中加入硝酸银溶液,生成物氯化铜也能与硝酸银反应生成白色沉淀氯化银,所以产生白色沉淀并不证明稀盐酸过量,选项错误,故选B。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案
相关题目
【题目】实验是化学重要的组成部分
实验内容 | 实验现象 | 实验分析 |
实验一: 将一小根生锈的铁丝放入一定量稀盐酸里 | 若盐酸是足量,可观察到的完整现象是:铁锈逐渐溶解,______ | 请写出盐酸与铁锈主要成分反应的化学方程式______ |
待铁丝全部溶解,向溶液中滴加硝酸银溶液,可观察到白色沉淀 | 该沉淀的化学式是________ 有同学认为这现象不足以证明反应后盐酸有剩余,理由是________ | |
实验二: 在 | 如果滤渣呈银白色 | 滤液中的溶质一定含有________ |
如果滤液呈蓝色 | 滤渣中的滴加足量盐酸,能否观察到气泡?______ | |
如果用铜棒代替锌粉,可观察到的现象是______ | 请写出反应的化学方程式______, 该反应的基本类型是______ |