��Ŀ����
����Ŀ��FeSO47H2O��һ����Ҫ��ʳƷ���������Ӽ���ij��ҵ������Ҫ�ɷ���Fe2O3��������CaCO8��SiO2���Ȳ�����ˮҲ������ϡ���ᣩ��ʵ�����ô˷����Ʊ�FeSO47H2O��������ͼ1��

���������ͼ�ش��������⣺
��1��ϡ�������ĩ�е���������Ӧ�Ļ�ѧ����ʽΪ______________________
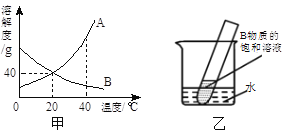
��2�������ڵ�������_______ ��
��3�����ⶨ��������ֻ����CaSO4��SiO2������Ϊʵ����___����ܡ����ߡ����ܡ����÷�ĩ״��ʯ��ʯ��ϡ���ᷴӦ��CO2.
��4���������ۺ���Ҫ����Ϊ���������ܽ⣬____________________ ��д��Fe��Fe2��SO4��3��Ӧ�Ļ�ѧ����ʽΪ__________________��
��5�������������ܽ��������ͼ2�����ᾧ��Ϻ��˳����壬��������ˮϴ��2��3�Σ��ñ�ˮϴ�ӵ�Ŀ���ǣ�

���ȥ������渽�ŵ����ʣ���___________________________________��
���𰸡� Fe2O3+3H2SO4=Fe2��SO4��3+3H2O�� ���ˣ� �� �����ݲ�������Һ��Ϊdz��ɫ�� Fe+Fe2��SO4��3=3FeSO4 ������������������ܽ⣻
��������(1)ϡ�������ĩ�е���������Ӧ��������������ˮ����ѧ����ʽΪ��Fe2O3+3H2SO4=Fe2(SO4)3+3H2O��(2)����Ŀ��ͼ���Կ��������������������Һ�壬�����Һ��������������������ǹ��ˣ�(3)��ҵ������Ҫ�ɷ���Fe2O3��������CaCO3��SiO2���Ȳ�����ˮҲ������ϡ���ᣩ������ϡ�������Ŀ��ָ���������ⶨ��������ֻ����CaSO4��SiO2����˵�������е�̼����Ѿ���ȫ��ϡ���ᷴӦ�������˶�����̼���壻(4)��ͼ��֪��Fe��Fe2(SO4)3��Ӧ����FeSO4����Ӧ����Fe��Fe2(SO4)3����������FeSO4���ʷ�Ӧ�Ļ�ѧ����ʽΪ��Fe+Fe2(SO4)3�T3FeSO4��(5)�����������ܽ��������ͼ1���Կ����������������ܽ�����¶ȵ����߶������ñ�ˮϴ�ӵ�Ŀ����һ����ȥ������渽�ŵ�����ˮ���ʣ�������ˮ���¶ȵͣ����������ڵ����µ��ܽ��С���ɽ���ϴ�ӹ������̷����ܽ����ɵ���ʧ��