题目内容
【题目】某同学利用如下实验研究酸的性质,并进行未知物检验
序号 | ① | ② | ③ | ④ |
实验 |
|
|
|
|
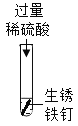
(1)实验①、②能体现出酸的化学性质是_____________;
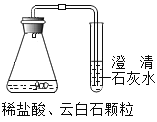
(2)实验③、④中澄清石灰水变浑浊的化学方程式为_____________;
(3)根据实验③、④出现的固体表面有气泡产生,澄清石灰水变浑浊现象,可得出关于方解石和白云石成分的结论是_____________。
【答案】酸能跟金属氧化物反应 CO2+Ca(OH)2=CaCO3↓+H2O 矿石的成分中含有碳酸盐(或碳酸钙)
【解析】
(1)铁锈的成分是氧化铁,实验①、②的反应中金属氧化物是相同的,酸是不同的,所以实验①、②能体现出酸的化学性质是:酸能跟金属氧化物反应;
(2)二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
(3)实验③、④中盐酸和方解石、云白石反应生成的气体能使澄清石灰水变浑浊,可得出关于方解石和白云石成分的结论是:含有碳酸盐。
故答案为:(1)酸能跟金属氧化物反应;
(2)CO2+Ca(OH)2=CaCO3↓+H2O;
(3)矿石的成分中含有碳酸盐(或碳酸钙)。

练习册系列答案
相关题目