题目内容
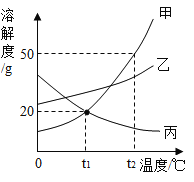
【题目】甲、乙、丙三种物质的溶解度曲线如图所示.根据图中信息回答下列问题:
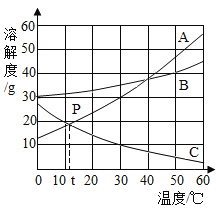
(1)P点的含义:_____。
(2)通过加溶质、恒温蒸发溶剂、升高温度均可使接近饱和的溶液变为饱和溶液的物质是:__。(填A、B或C)
(3)将60℃时A、B、C三种物质的饱和溶液分别降温至10℃时,所得三种溶液的溶质质量分数由大到小的顺序为_____。
(4)30℃时分别向等质量的A、B、C三种物质中加水配制成三种物质的饱和溶液,所得溶液质量最小的是____。
【答案】在t℃时AC的溶解度相等 C B>A>C A
【解析】
(1)据图可以看出,P点表示在t℃时AC的溶解度相等,故填:在t℃时AC的溶解度相等;
(2)C的溶解度随温度的升高而减小,故升高温度能使C的不饱和溶液变为饱和溶液,加溶质、恒温蒸发溶剂也能使C的不饱和溶液变为饱和溶液,故填:C;
(3)将60℃时A、B、C三种物质的饱和溶液分别降温至10℃时,AB的溶解度随温度的降低减小,在10℃时,B的溶解度大于A,故B的溶质质量分数大于A,而C的溶解度随温度的降低而增大,溶液组成不变,故所得三种溶液的溶质质量分数由大到小的顺序为B>A>C,故填:B>A>C;
(4)30℃时分别向等质量的A、B、C三种物质中加水配制成三种物质的饱和溶液,A的溶解度最大,所需的水的质量最小,故所得溶液质量最小,故填:A.

【题目】某同学利用如下实验研究酸的性质,并进行未知物检验
序号 | ① | ② | ③ | ④ |
实验 |
|
|
|
|
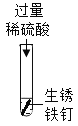
(1)实验①、②能体现出酸的化学性质是_____________;
(2)实验③、④中澄清石灰水变浑浊的化学方程式为_____________;
(3)根据实验③、④出现的固体表面有气泡产生,澄清石灰水变浑浊现象,可得出关于方解石和白云石成分的结论是_____________。
【题目】实验室常用下列装置制取气体,请根据所学知识回答。
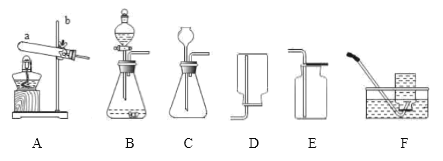
(1)写出图中仪器名称:a________________;b________________。
(2)实验室用A装置制取氧气。
I.反应的化学方程式为________________________,搭建A装置时,酒精灯应在固定仪器a之________(选填“前”或“后”)放置。
II.从反应后的剩余固体中回收得到二氧化锰的操作步骤顺序是________。(请填写编号)
①洗涤 ②过滤 ③烘干 ④溶解
(3)实验室在常温下用块状电石与水反应制取乙炔气体,该反应必须严格控制加水速度,以免引起发生装置炸裂。上图中最适合制取乙炔气体的发生装置是________(填装置编号)。
(4)选用F装置收集较纯净氧气的适宜时刻是________。也可选择E装置收集氧气,依据是________,证明氧气已集满的方法为________________。
(5)选用C装置,将一定量的双氧水和二氧化锰混合,充分反应,测得反应的总质量(m)与反应时间(t)的数据如下表所示:
反应时间t/s |
|
|
|
|
|
|
总质量m/g | 50 | 49.0 | 48.1 | 47.3 | 46.8 | 46.8 |
根据题目要求,回答下列问题:
I.双氧水和二氧化锰完全反应生成氧气的质量是________________;
II.分解的过氧化氢的物质的量是多少摩尔?(列式计算)________________________。
【题目】请根据下列各图中提供的信息回答问题。
I.实验室制备并收集二氧化碳。
选用药品。按下表进行实验,取等质量的大理石加入足量酸中(杂质不与酸反应),产生二氧化碳体积随时间变化曲线如图所示。(提示:硫酸钙微溶于水)
实验编号 | 药品 |
Ⅰ | 块状大理石、10% H2SO4溶液 |
Ⅱ | 块状大理石、7% HCl溶液 |
Ⅲ | 大理石粉末、7% HCl溶液 |
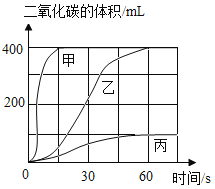
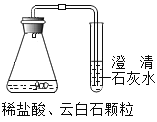
图中丙对应实验________(选填“Ⅰ”、“Ⅱ”或“Ⅲ”)确定用乙对应的药品制备并收集二氧化碳,反应的化学方程式是_____________________。
Ⅱ.利用以下实验装置进行实验,请回答下列问题。
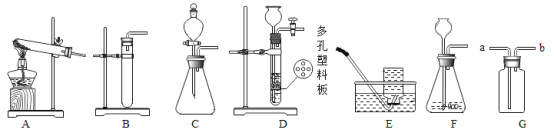
(1)加热高锰酸钾制取并收集较为纯净的氧气,选用的装置是_________(填写字母)。写出反应的化学方程式_______________________。
(2)装置D、F都可用来制取二氧化碳,装置D相对于装置F的优势是______________。若用G装置收集二氧化碳,气体应从____________(填a或b)端进入。