题目内容
【题目】小明同学家新换了水龙头,从说明书上了解到该水龙头是钢质镀铬。好奇的小明想探究铬(Cr)与常见金属铁、铜的活动性强弱,遨请你一同参加。
(1)作出猜想:
猜想1:Cr>Fe>Cu
猜想2:Fe>Cu>Cr
猜想3:你的猜想是___。
[查阅资料]
①铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
②铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
(2)设计实验
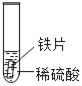
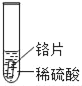
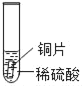
小明同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸。
实验 | 试管1 | 试管2 | 试管3 |
实验操作 |
|
|
|
实验现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 | ___ |
(3)结论与解释:
①小明得到的结论是猜想___正确。
②实验前用砂纸打磨金属片的目的是___。
(4)反思:小明将铬片投入FeSO4溶液中,现象是___,请你写出反应的化学方程式___。
【答案】Fe>R>Cu 无明显现象 1 去除金属表面的氧化膜,防止影响实验现象 铬表面覆着着黑色固体,溶液由浅绿色变为蓝色 FeSO4+Cr═CrSO4+Fe
【解析】
(1)作出猜想:由于铁、铜的活动性顺序为Fe>Cu,则金属Cr可放在前、后、中间位置;故答案为:Fe>R>Cu
(2)设计实验:在金属活动性顺序中H>Cu,所以铜片不能与稀硫酸反应。故答案为:无明显现象
(3)结论与解释:
①可通过金属与酸的反应剧烈程度来比较金属的活动性,金属与酸反应越剧烈,则金属的活动性越强。铬与酸反应产生气泡比铁与酸快,铜不与酸反应;故金属活动性顺序:Cr>Fe>Cu.故答案为:1
②金属表面易生成一层的氧化膜,影响反应现象;故需打磨除去氧化膜。故答案为:去除金属表面的氧化膜,防止影响实验现象。
(4)反思:
铬比铁活泼,铬和硫酸亚铁溶液发生置换时生成铁和硫酸亚铬。故答案为:铬表面覆着着黑色固体,溶液由浅绿色变为蓝色;FeSO4+Cr═CrSO4+Fe