题目内容
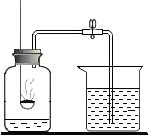
【题目】某实验小组的同学要从BaCl2、NaCl混合溶液中得到较纯净的BaCl2和NaCl晶体,为此进行下列实验设计和操作,请回答下列问题. 【提出问题】如何分离BaCl2和NaCl,并得到两种晶体?
【设计方案并实验】
张南同学的实验方案:取一部分混合液于试管中,先向其中加入适量的Na2SO4溶液,过滤,向滤渣中加入适量稀盐酸,将滤液蒸发结晶.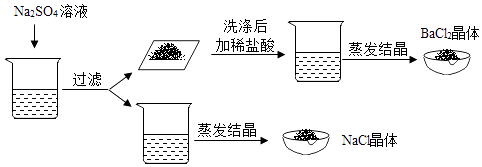
小岗同学的实验方案:取一部分混合液于试管中,先向其中加入过量的Na2CO3溶液,过滤,向滤渣中加入过量稀盐酸,将滤液蒸发结晶.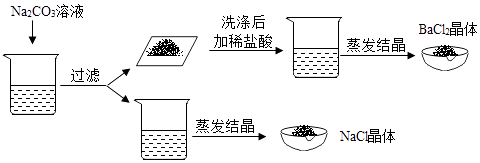
(1)【填写实验报告】 请写出张南同学加入Na2SO4溶液后反应的化学方程式
(2)小岗同学向滤渣中再加入过量稀盐酸的实验现象是
(3)【交流与评价】 小岗同学认为张南同学实验方案不合理,理由是
(4)小岗同学的实验中加入过量的Na2CO3溶液后,所得溶液中的离子有①(填离子符号) 张南同学认为加入过量稀盐酸可以把碳酸钠杂质去掉,这样做会使所得的氯化钠溶液含有杂质离子,所以方案不合理,但小岗同学认为只要把滤液进行蒸发结晶就不会影响实验结果,在进行蒸发操作时,当② , 停止加热.
(5)【反思与总结】 小岗同学在进行操作时所用试剂都是过量的,但后来得到物质确是纯净的,由此我们得出的经验是:如果我们前面加入试剂不能控制适量,那么可以通过除去干扰离子,而不产生杂质离子或引入干扰离子.
【答案】
(1)BaCl2+Na2SO4═BaSO4↓+2NaCl;
(2)白色固体逐渐溶解,产生气泡;
(3)向其中加入适量的Na2SO4溶液时,硫酸钠和氯化钡反应生成白色沉淀硫酸钡,过滤,向滤渣中加人适量稀盐酸时,硫酸钡不能和稀盐酸反应,因此不能得到氯化钡晶体
(4)Na+、Cl﹣、CO32﹣;出现较多固体时
(5)后面加入的试剂与前面加入的过量试剂反应
【解析】解:(1)氯化钡和硫酸钠反应产生硫酸钡沉淀和氯化钠,因此反应的方程式为:BaCl2+Na2SO4═BaSO4↓+2NaCl;故填:BaCl2+Na2SO4═BaSO4↓+2NaCl;(2)碳酸钡和盐酸反应产生氯化钡、水和二氧化碳,因此会观察到的现象为:白色固体逐渐溶解,产生气泡;故填:白色固体逐渐溶解,产生气泡;(3)由于硫酸钠和氯化钡反应生成白色沉淀硫酸钡,而硫酸钡不和盐酸反应,因此不能得到氯化钡;故填:向其中加入适量的Na2SO4溶液时,硫酸钠和氯化钡反应生成白色沉淀硫酸钡,过滤,向滤渣中加人适量稀盐酸时,硫酸钡不能和稀盐酸反应,因此不能得到氯化钡晶体;(4)碳酸钠和氯化钡反应产生碳酸钡沉淀和氯化钠,因此滤液中含有氯化钠中的钠离子和氯离子,且过量的碳酸钠,其中含有的离子为钠离子和碳酸根离子,因此溶液中含有钠离子、氯离子和碳酸根离子,符合为:Na+、Cl﹣、CO32﹣;蒸发时要等到出现大量固体时停止加热,靠余热烘干;故填:Na+、Cl﹣、CO32﹣;出现较多固体时;(5)在进行操作时所用试剂往往都是过量的,要得到物质是纯净的,可以通过后面加入的试剂与前面加入的过量试剂反应除去干扰离子,而不产生杂质离子或引入干扰离子;故填:后面加入的试剂与前面加入的过量试剂反应.
【考点精析】本题主要考查了书写化学方程式、文字表达式、电离方程式的相关知识点,需要掌握注意:a、配平 b、条件 c、箭号才能正确解答此题.

 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案【题目】化学兴趣小组对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与硫酸的质量分数有关;b.可能与锌的形状有关。
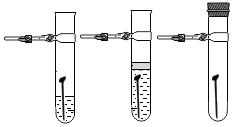
【设计并实验】用不同质量分数的硫酸和不同形状的锌进行如下实验。
实验编号 | 硫酸的质量分数(均取20mL) | 锌的形状(均取1g) | 氢气的体积(mL)(均收集3分钟) |
① | 20% | 锌粒 | 31.7 |
② | 20% | 锌片 | 50.9 |
③ | 30% | 锌粒 | 61.7 |
④ | 30% | 锌片 | 79.9 |
(1)写出稀硫酸与锌反应的化学方程式。
(2)用下图装置收集并测量氢气的体积,其中量筒的作用是 , 氢气应从(填e或f或g)管通入。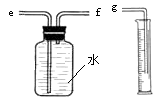
(3)【收集证据】要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是。
(4)【得出结论】结论是。
【题目】分类、类比是初中化学常用的学习方法.请回答下列问题:
(1)初中化学有许多实验中都用到了水,但是用水作用是不同的,将下列实验中的B与①(填字母)归为一类,理由是②
|
|
|
|
A | B | C | D |
(2)1865年,俄国学者贝开托夫(Beketob)在实验的基础上,根据金属和金属离子间互相置换能力的大小,以及金属跟酸、水等反应的剧 烈程度,首先确定了金属活动性顺序,在这个顺序里包括了氢.在金活动性顺序中活动性越强,其金属的还原性也越强.确定金属的活动性也可以根据元素在元素周期表中的位置判断,如图是元素周表的一部分.请回答下列问题. 
金属活动性顺序为:K Ca Na Mg…
请推断金属铍的佥属活动性比金属镁的活动性①(填“强”或“弱”);金属锂的还原性比金属镁的还原性②(填“强”或“弱”).