题目内容
【题目】某化学兴趣小组想探究食用碱的成分(主要成分为Na2CO3),选择厨房里的一包食用碱,上面的标签如图1。取该食用碱样品10. 9g,加入99. 1g水溶解,将CaCl2溶液慢慢滴入到该溶液中,将实验过程中得到的结果绘制,得到图2。求:
××纯碱
主要成分:碳酸钠
(含量≥95%)
其他成分:氯化钠
图1
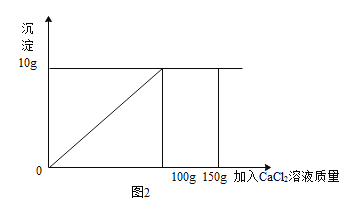
(1)溶液中刚好完全反应所生成的沉淀为 。
(2)纯碱样品中Na2CO3的质量分数为多少? (计算结 果保留一位小数)
(3)当溶液刚好完全反应时,所得溶液中溶质的质量分数。(计算结 果保留一位小数)。
【答案】(1)CaCO3 (或碳酸钙);(2)97.2;(3)6.0%
【解析】
解:(1)由图像可知:碳酸钠与氯化钙反应产生碳酸钙沉淀的质量为10g;
(2)设:参加反应碳酸钠的质量为x,生成氯化钠的质量为y
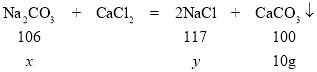
![]() x=10.6g
x=10.6g
![]() y=11.7g
y=11.7g
纯碱中碳酸钠的质量分数=![]() ;
;
(3)所得氯化钠溶液中溶质的质量分数=![]() 。
。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】向下表中的甲物质中逐滴加入乙物质溶液至过量,反应生成气体或沉淀的质量与加入乙的质量关系符合如下曲线描述的是
选项 | 甲 | 乙 |
A. | 铜、锌的混合物粉末 | 稀盐酸 |
B. | 盐酸和稀硫酸的混合溶液 | 氯化钡溶液 |
C. | 氯化钠和氯化钙的混合溶液 | 碳酸钠溶液 |
D. | 盐酸和氯化铜的混合溶液 | 氢氧化钠溶液 |
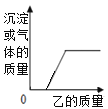
A. AB. BC. CD. D