题目内容
【题目】根据下列装置图回答问题。
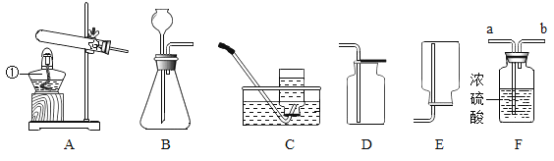
(1)图中标示①仪器的名称是_______。
(2)实验室用高锰酸钾制取氧气反应的化学方程式为_______,该反应的基本反应类型为______。
(3)实验室制取一瓶干燥的二氧化碳气体,应该选择的装置是____(填装置编号),反应的化学方程式为____。
【答案】酒精灯 2KMnO4![]() K2MnO4+MnO2+O2↑ 分解反应 BFD CaCO3+2HCl═CaCl2+H2O+CO2↑
K2MnO4+MnO2+O2↑ 分解反应 BFD CaCO3+2HCl═CaCl2+H2O+CO2↑
【解析】
(1)据图可知仪器①的名称是酒精灯;
(2)实验室用高锰酸钾制取氧气的反应的化学方程式为2KMnO4![]() K2MnO4+MnO2+O2↑,该反应的基本反应类型是分解反应;
K2MnO4+MnO2+O2↑,该反应的基本反应类型是分解反应;
(3)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,反应的化学方程式CaCO3+2HCl═CaCl2+H2O+CO2↑,因此不需要加热,应选装置B;要得到一瓶干燥的二氧化碳气体,用浓硫酸干燥,并且都是长进短出即BFD。

 暑假作业暑假快乐练西安出版社系列答案
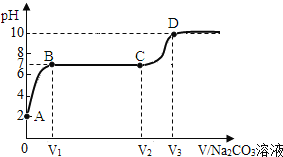
暑假作业暑假快乐练西安出版社系列答案【题目】在氢氧化钠溶液中逐滴滴加稀盐酸。实验过程中溶液温度的变化及实验操作如图一、图二所示:
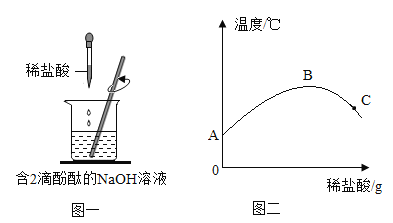
(1)在氢氧化钠溶液中滴加无色酚酞的作用是_____。
(2)根据图二所示:AB段曲线上升的原因是_____;C点时溶液中所含的阳离子有__。
(3)已知氢氧化钠稀溶液的浓度和相应的pH值如下表所示:
①根据下表推断,当溶液的pH值近似为12时,氢氧化钠溶液的溶质质量分数为___。
溶液中氢氧化钠的质量分数 | 近似pH值 |
4% | 14 |
0.4% | 13 |
12 | |
0.004% | 11 |
0.0004% | 10 |
②计算在50g溶质质量分数为4%的氢氧化钠溶液中,加入30g浓度为3.65%的稀盐酸,充分反应后所得溶液中氢氧化钠的质量分数为________,所得溶液的pH范围是_____ (填字母)。
A 10~11 B 11~12 C 12~13 D 13~14
(4)某造纸厂有10 t含NaOH的质量分数为3.2%的废水,现要用溶质质量分数为3.65%盐酸进行处理至中性后排放,需要这种盐酸的多少吨____?(废水中其他物质不与盐酸反应,写出计算过程)