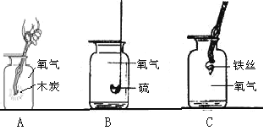
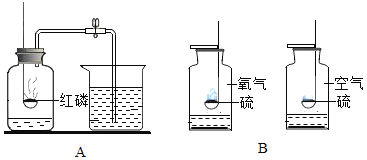
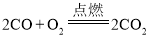题目内容
【题目】用化学符号或化学符号和数字的组合来表示:
(1)地壳含量最多的金属元素是____;
(2)2个氧分子_____;
(3)3个镁离子_____;
(4) 所表示的粒子符号为____;
所表示的粒子符号为____;
【答案】Al 2O2 3Mg2+ S2-
【解析】
(1)地壳中含量最多的金属元素是铝元素,其符号为:Al;
(2)分子的表示方法:正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,所以两个氧分子可表示为2O2;
(3)离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。若表示多个该离子,就在其元素符号前加上相应的数字,故3个镁离子可表示为:3Mg2+;
(4)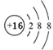 该粒子的质子数小于核外电子数,属于硫离子,硫离子表示为S2-。
该粒子的质子数小于核外电子数,属于硫离子,硫离子表示为S2-。
故答案为:(1)Al;(2)2O2;(3)3Mg2+;(4)S2-。

 阅读快车系列答案
阅读快车系列答案【题目】兴趣小组的同学了解到氯气(![]() )是黄绿色气体,它的水溶液叫氯水。当同学们将紫色石蕊溶液滴入氯水中,惊奇地发现溶液先变红,后褪色。
)是黄绿色气体,它的水溶液叫氯水。当同学们将紫色石蕊溶液滴入氯水中,惊奇地发现溶液先变红,后褪色。
(提出问题)氯水中的哪些成分能使紫色石蕊溶液先变红后褪色呢?
(查阅资料)
(1)氯气溶于水,部分与水反应,生成盐酸和次氯酸,反应方程式为![]() 。
。
(2)次氯酸,具有强氧化性,见光会分解,其反应方程式为: 。
。
(3)酸溶液都能使紫色石蕊溶液变为红色。
(分析问题)
使紫色石蕊溶液变红的主要是氯水中的________和________。那么,氯水中的哪些成分使石蕊褪色呢?
(作出猜想)
猜想1:是氯水中的水使石蕊溶液褪色; 猜想2:是氯水中的________使石蕊溶液褪色;
猜想3:是氯水中的盐酸使石蕊溶液褪色; 猜想4:是氯水中的次氯酸使石蕊溶液褪色。
(实验探究)取四朵用石蕊溶液染成紫色的干燥的纸花进行以下实验。
实验操作 | 实验现象 | 实验结论 |
①第一朵纸花喷上水 | ①没有明显变化 | 猜想1_______ |
②第二朵纸花直接放入盛有干燥_______的集气瓶中 | ②没有明显变化 | 猜想2不成立 |
③第三朵纸花喷上盐酸 | ③变红,但_______ | 猜想3不成立 |
④第四朵纸花喷上水后,放入盛有干燥_______的集气瓶中 | ④先变红,后褪色 | 猜想4_______ |
(实验结论)
综合分析判断:氯水中的_______(填化学式)使紫色石蕊溶液褪色,它具有漂白作用(能将紫色石蕊等有色物质氧化而褪色)。
(拓展与应用)实验室中保存氯水的方法是_______。
【题目】(a)为探究催化剂的种类对氯酸钾分解速率的影响,甲设计以下对比实验:
①将3.0克氯酸钾和1.0克二氧化锰均匀混合加热;②将3.0克氯酸钾和1.0克氧化铜均匀混合加热。
在相同温度下,比较两组实验产生氧气的快慢。
(猜想)除二氧化锰,氧化铜外,氧化铁也可以做氯酸钾分解的催化剂。
按下表进行实验:测定分解温度(分解温度越低,催化效果越好)
实验编号 | 实验药品 | 分解温度/℃ |
① | 氯酸钾 | 580 |
② | 氯酸钾、二氧化锰(质量比1∶1) | 350 |
③ | 氯酸钾、氧化铜 (质量比1∶1) | 370 |
④ | 氯酸钾、氧化铁 (质量比1∶1) | 390 |
问题一:实验所用的三种物质,催化效果最好的是______________ (填催化剂名称)
(b)以下是某研究小组探究影响化学反应快慢的一些因素的相关数据(常温通常指20℃)
实验序号 | 过氧化氢溶液浓度/% | 过氧化氢溶液质量/g | 温度/℃ | 二氧化锰用量/g | 氧气体积/ml | 反应所需时间/s |
① | 5 | 12 | 20 | 0.2 | 125 | 11 |
② | 30 | 12 | 20 | 0.2 | 125 | 2 |
③ | 30 | 12 | 40 | 0 | 125 | 148 |
④ | 30 | 12 | 90 | 0 | 125 | 82 |
问题二:(1)写出以上反应的文字表达式____________
(2)通过对比实验①和②可知,化学反应快慢与 _______有关;通过对比实验③和 __________可知,化学反应快慢与温度有关。
(3)由上述实验可知,实验室用过氧化氢制取氧气的最合适的条件是序号 ________
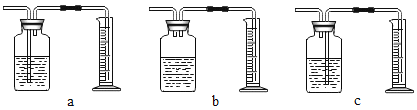
(4)本实验中测量氧气体积的装置(下图)应该选择:________ (填字母)
(5)问题三:查阅资料得知,氧化铜、硫酸铜、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是 (_____)
A 二氧化锰只能作过氧化氢溶液分解的催化剂
B 同一个化学反应可以有多种催化剂
C 催化剂只能加快化学反应的速率
D 用作催化剂的物质不可能是其他反应的反应物或生成物