题目内容
【题目】学习小组尝试从反应物消耗和新物质生成两个不同的角度,验证 CO2与 NaOH溶液发生了反应。
(查阅资料)
Ⅰ.常温下,NaOH易溶于水也易溶于酒精,Na2CO3易溶于水但难溶于酒精。
Ⅱ.BaCl2溶液呈中性,CO2不溶于酒精也与酒精不反应。
(实验探究)(相关装置气密性良好,省略夹持仪器)
实验一 | 实验二 | 实验三 |
|
|
|
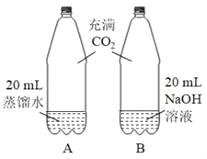
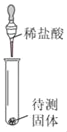
①实验一:振荡后,两个软塑料瓶中变瘪程度更大的是_____(选填“A”或“B”)。
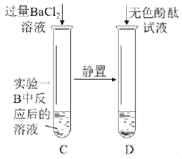
②实验二:D中滴入酚酞后呈_____色,证明B瓶溶液中NaOH已反应完了。若C中不加BaCl2溶液,直接滴入酚酞试液,能否达到实验目的?理由是_____。
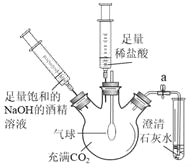
③实验三:关闭止水夹a,注入足量饱和的NaOH的酒精溶液,振荡后观察到的现象是_____,发生反应的化学方程式为_____。一段时间后,注入足量的稀盐酸,打开止水夹a,观察到的现象是_____。
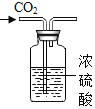
④实验四:向瓶中分别加入等体积的蒸馏水和 NaOH 溶液,用传感器测得瓶中气压变化的图象,如图所示。
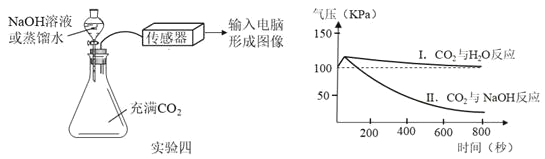
分析上述图象,能否证明CO2与NaOH溶液发生了反应?理由是_____。
(总结归纳)
以上四个实验中,既从反应物消耗角度,又从新物质生成角度,证明NaOH与CO2发生了反应的实验是_____(选填“一”、“二”、“三”或“四”)。
【答案】B 无 不能;碳酸钠溶液和氢氧化钠溶液都呈碱性,无法验证CO2和NaOH溶液发生了反应 气球变大,瓶内产生白色固体 2NaOH+CO2=Na2CO3+H2O 试管内澄清石灰水变浑浊 对比分析曲线Ⅱ和Ⅰ,CO2和NaOH溶液反应后,容器内气压下降得更低 二、三
【解析】
①由于二氧化碳能溶于水,二氧化碳与氢氧化钠反应生成了碳酸钠和水,所以两个塑料瓶中共同的现象都会变瘪,其中二氧化碳与氢氧化钠的反应消耗二氧化碳的量大,B瓶变化程度更大;
②氢氧化钠溶液能使无色酚酞试液变红色,D中滴入酚酞后呈无色,证明B瓶溶液中NaOH已反应完了;碳酸钠溶液和氢氧化钠溶液都呈碱性,无法验证 CO2和 NaOH溶液发生了反应;
③二氧化碳和氢氧化钠反应生成碳酸钠,瓶内气体压强减少,在外界大气压的作用下,气球变大;由于碳酸钠难溶于酒精,形成沉淀析出;发生反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O;碳酸钠和盐酸反应生成二氧化碳,打开止水夹a,观察到试管内澄清石灰水变浑浊;
④根据上述图象,能证明CO2与NaOH溶液发生了反应,理由是对比分析曲线Ⅱ和Ⅰ,CO2和 NaOH 溶液反应后,容器内气压下降得更低;
[总结归纳]通过对以上实验进行分析可知,以上四个实验中,既从反应物消耗角度,又从新物质生成角度,证明NaOH与CO2发生了反应的实验是二、三。。

 天天向上口算本系列答案
天天向上口算本系列答案